Inscription / Connexion Nouveau Sujet
Pression Osmotique
Bonsoir , j'ai un petit problème par rapport à une question d'un exo , on me donne une certaine solubilité : iodure de tantale dans l'eau à 25°C est égale à 2.31*10^−4 mol L/1. Et on me demande de déterminer la pression osmotique d'une solution saturée de iodure de tantale à 32°C . Je suis bloquée sur la résolution . Je pensais utilisé la relation 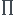 =RTc mais ici la solubilité me perturbe et je ne sais pas si je dois prendre en compte ou pas l'eau ou seulement l'iodure de tantale . Voilà merci pour votre aide .
=RTc mais ici la solubilité me perturbe et je ne sais pas si je dois prendre en compte ou pas l'eau ou seulement l'iodure de tantale . Voilà merci pour votre aide .
Bonjour,
Que voulez-vous dire en prenant seulement en compte l'eau ?
Que voulez-vous dire en prenant seulement en compte l'iodure de tantale ? Il y a d'autres espèces en solution ?
Non en faite , je viens de relire ce que j'ai écris et regarder mon cours on me dit bien que je dois prendre en compte seulement les concentrations des solutés , or ici l'eau n'en est pas(solvant) donc je dois prendre en compte seulement l'iodure de tantale . Mais par contre je suis toujours perturbé par cette histoire de solubilité .
La solubilité permet de déterminer la concentration des solutés.
Qu'elle est la définition de la solubilité ?
Pas exactement : la solubilité est la quantité de matière maximale du composé qui peut être dissoute dans une unité de volume.
Ok , pour faire le lien entre cette dernière et la concentration des solutés je dois faire un tableau ?
Oui, vous pouvez faire un tableau d'avancement, mais surtout écrire la réaction de dissociation. À ce propos, il y a plusieurs iodure de tantale, j'espère que votre énoncé est plus précis que ce que vous avez indiqué.
D'accord , oui effectivement je n'ai pas pensé à le précisé je pensais qu'il y en avait qu'un , iodure de tantale en question est TlI= Tl+(aq) +I-(aq)
x 0 0
x-s s s
Moi je n'en ai aucune certitude malheureusement , je recopie seulement mon énoncé , du coup la concentration des solutés correspond à s² ?
Si s est une concentration, est-ce que s2 peut être une concentration ?
La concentration c qui intervient dans la pression osmotique est la concentration totale, autrement dit la somme des concentrations.
En faite c'est écrit Tl (ici l c'est en faite L minuscule ) et I(iode) , mais j'ai une dernière question ça pose pas de problème ici que la concentration totale soit exprimée à 25°C et qu'on me demande la pression osmotique à 32°C ? , je dois pas calculer la concentration totale à 32°C et après faire mon calcul de pression osmotique ?
Si il faut calculer la concentration à 32°C mais si vous n'avez pas d'autre renseignement (du type enthalpie de la réaction de dissociation), vous pouvez garder le c calculé.
Sinon vous pouvez demander où ils se procurent le TaI, je ne l'ai trouvé ni chez Merck, ni chez Aldrich, ni chez Fischer ; et le tantale chez ces fournisseurs est majoritairement du V et jamais du I.
Bonsoir gts2, bonsoirInconnu00,
[quote]
Petit rappel du tableau périodique :
Thallium : symbole Tl (L minuscule) : nombre d'oxydation le plus fréquent : +I
Tantale : symbole Ta : nombre d'oxydation privilégié : +V
Titane : symbole Ti (i minuscule) : nombres d'oxydations fréquents : +II , +III, +IV.


Bonsoir vanoise,
J'étais tellement perturbé par ce iodure de tantale, que je n'avais pas lu TlI mais TaI !
Merci, donc c vaut bien 2s.
Ou bien je calcul la pression osmotique à 25°C et après je fais un lien avec la pression osmotique à 32°C
Vous faites le calcul à 32°C, à moins, je répète, que vous n'ayez des données plus précises : on confond s(25) et s(32).
Je n'ai aucune autre données , et donc le calcul final c'est bien : 8.314*(32+273)*2s ?
du coup c'est bien comme ça alors ?


