Inscription / Connexion Nouveau Sujet
Précipité et dissolution
Salut à tous,
J'ai un exercice qui me pose problème en chimie, en fait je ne vois pas du tout comment m'y prendre avec ce type d'énoncé ...
Voici l'énoncé :
L'oxaolate de calcium est un crital ionique tres peu soluble dans l'eau, de formule CaC2O4, composé d'un ion calcium Ca2+ et d'un ion oxalate C2O4 2-.
On mélange 50 mL d'une solution d'oxalate d'ammonium (2 NH4+, C2O42-) à 0,05 mol.L-1, et 50 mL d'une solution de nitrate de calcium (Ca2+, 2NO3-) à 0,02 mol.L-1.
1) Montrer que l'on observe la formation d'un précipité d'oxalate de calcium. Quelle est la masse de précipité obtenue ?
2) Le précipité est récupéré par filtration sous vide, puis lavé à l'aide de 50 mL d'eau distillée. Quelle masse de précipité est redissoute lors de cette opération ?
3) Même question si le précipité est lavé à l'aide de 50 mL d'une solution d'oxalate d'ammonium de concentration 0,050 mol.L-1. Commenter le résultat obtenu.
Données: pKS(Ca(C2O4)) = 8,6 ; M(Ca(C2O4) = 128,1 g.mol-1
************************************************
Pour la question 1, c'est ok !
Par contre pour la question 2 et 3, je ne comprend pas comment faire, je ne sais pas quelle équation bilan écrire pour recalculer la masse du précipité...
Merci d'avance 
Bonjour,
Pour la question 2 : écris l'équation de la réaction de dissolution et fait un tableau d'avancement. Puisque l'énoncé précise que la dissolution n'est pas totale, on peut considérer que l'équilibre de précipitation existe. Cela devrait te conduire à :
Connaissant les concentrations et le volume, tu peux déterminer les quantités...
question 3 : même méthode mais la quantité initiale d'ions oxalate n'est pas nulle.
Salut et merci de ta réponse 
Pour la reaction de dissolution, on a :
CaC2O4 = Ca2+ + C2O42-
Mais, pour faire le tableau d'avancement, on prend [CaC2O4 ], obtenu à la question 1) ?
Mais où interviens le volume d'eau rajouté ?
La réaction de dissolution est la réaction inverse.
L'oxalate de calcium est un solide : parler de sa concentration n'a pas de sens !
Dans ton tableau d'avancement, il faut raisonner en quantités (en moles) après avoir calculer comme je te l'ai expliqué les concentrations des ions...
Encore merci de ta réponse 
La réaction inverse ? ça me parait bizarre, dans mon cours, on a écrit les reaction de dissolution dans se sens...
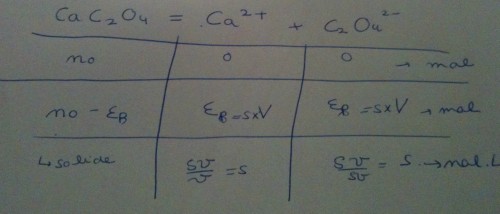
Voici mon tableau d'avancement : (la première ligne correspond à l'état initial, et les deux autres à l'état final )
J'ai appelé no, la quantité de matière initial de CaC2O4
Du coup on a bien :
Avec Ks =10-8.6
Or
Et on prend V = 50 mL ?
Bonjour
ça me parait bizarre, dans mon cours, on a écrit les reaction de dissolution dans se sens...
Puisque'il s'agit de réactions réversibles, les deux écritures sont possibles. Disons qu'il est plus logique de prendre pour réactifs les espèces initialement présentes, sinon, l'étude est possible mais conduit à un avancement négatif...
Ici le sens que tu as utilisé dans ton tableau d'avancement est le plus simple. En revanche, s'il s'agit d'étudier l'apparition d'un précipité, le sens inverse est plus approprié. C'est une affaire de contexte expérimental...
Et on prend V = 50 mL ?
Oui !

 10-5 mol.l
10-5 mol.l

