Inscription / Connexion Nouveau Sujet
Piles/Oxydoréductions
Bonjour, je vais être honnête j'ai pris extrêmement de retard dans mon tp de chimie. Je pensais pouvoir le faire plus facilement mais je me suis surestimé je crois bien ^^". Du coup j'aurais besoin d'aide pour finir ce tp afin de libérer du temps pour révisé mes partiels ^^". Je sais je me suis très mal organisé ^^". Merci de votre aide.
Voici les questions :
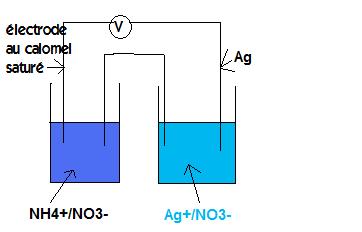
-Ecrire la relation de Nernst pour le couple Ag+ et en déduire l'équation donnant la f.e.m notée  E de la pile
E de la pile
-Tracer le graphique  E=f(log
E=f(log. Que représente l'ordonnée à l'origine ?
-Montrer que cette dernière donnée permet d'accéder à la valeur de E du couple Ag+/Ag à la température de l'expérience. Comparer cette valeur à celle donnée dans les tables de potentiels standars des couples redox
Mes résultats
EAg+/Ag -RT/nF* ln([Ag]/[Ag+]
pour le couple Ag+/Ag
J'en déduis l'équation globale en faisant en 1er les demi équations de chaque couple :
Ag+ + 1e- = Ag (1 électron)
NH4+ + 3H2O= NO3-+10H++8e- (8 électrons)
L'équation bilan est :
8Ag + NH4+ + 3H2O = 8Ag+ + NO3- + 10H+
L'équation devrait être :
E(d) - E(g) - 8,314*(18+273)/8*96500 * ln ([Ag+][NO3-]/[Ag][NH4+]
La température de la salle était de 18°C, le nombre d'électrons échangés est de 8, R= 8,314; F=96500 .
Pour le graphique voir index
L'ordonnée à l'origine représente la f.e.m = 0V soit à l'équilibre.
On en déduit que la valeur de E est d'environ 0.530 V. Pour ma part je pensais repartir de la relation de Nersnt en supposant E = 0. (je sais qu'on dis pas comme ça mais le raisonnement est bon je pense)
f.e.m = 0 = -RT/nf * ln (Ag+/Ag)
Ag étant une électrode on note 1 à la place
f.e.m = 0 = -RT/nf * ln (Ag+/Ag)
=
=0.057V
Pour un concentration de 10-3 de Ag+ via le calcule.
Nous avons au cours de notre Tp mesure pour trois différentes concentrations de Ag+ la f.e.m de la pile.
Voici les résultats expérimentaux :
Pour 10-1=0.498 V
Pour 10-2=0.457 V
Pour 10-3=0.398 V
Pour 10-4=0.324 V
Pour 10-5=0.314 V
J'écris la suite, j'aimerais déjà vérifié ça
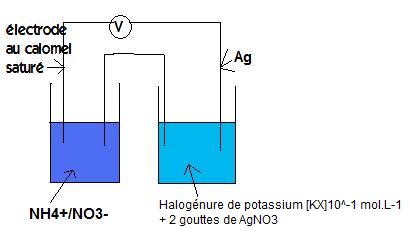
Dans la seconde manipulation on a mesuré la f.e.m de cette pile (voir index) lorsque l'halogénure de potassium est :
KCl à 10-1 mol.L-1 on trouve 0.006 V
KBr à 10-1 mol.L-1 on trouve -0.095 V
Kl à 10-1 mol.L-1 on trouve -0.032 V
Questions :
-Que sa passe t-il lorsqu'on ajoute trop d'AgNO3 dans la solution d'halogénure ?
-Établir l'expression littérale de la f.e.m de cette pile notée E.
-Calculer la concentration en Ag+ dans le bac dans chacun des trois cas (on considéra le potentiel standard du couple Ag+/Ag estimé dans la partie précédente sauf si la valeur est très éloigné de la valeur théorique)
-Calculer les produis de solubilité de AgCl, AgBr, et Agl. Comparer les valeurs Ks obtenus avec les valeurs littéraires cherchées.
-Calculer la solubilité (en g.L-1) des trois halogénures d'argent dans l'eau à la température de l'expérience
*Celles en rouge sont celles avec lesquels je bloque le plus : S
-La polarité de la pile va s'inverser et on aura une valeur négative de la f.e.m, ce qui veut dire que le courant circule dans le sans inverse du gamma.
EKX/AgNO3-- ENH4+/NO3--RT/nF x
On cherche Ox(d)
J'ai pas mis les étapes intermédiaires car je pense que latex aurait planter alors je met la première et dernière ligne. Mais si jamais vous les voulez je trouverais un moyen de rendre plus lisible le résultat.
Ed-Eg - * ln(
exp(-Ed+Eg++ln(Ox(g)+ln(Red(d))+ ln(Red(g) = Ox(d)
-Les solubilités
Pour AgCL
Espèces en solution : Ag+, Cl-, OH-, H3O+
EN: Ag++H3O+=Cl-[/sup+OH[sup]-
On va négliger Ag+ en supposant que Ag>>Ag+
Ce qui nous donne [H3O+]=[Cl-]+[OH-]=0
[H3O+]²-[Cl-][H3O+]-Ke=0
On prendra Co=[Cl-]
On calcule le discriminant :  =(-Co)²-4x1x(-Ke)
=(-Co)²-4x1x(-Ke)
=Co²+4Ke
S =
Hum...j'aurais peut-être du négliger Cl- au final non ?
Après je pense que c'est le même principe pour les deux autres.
Produits des solubilités littéraires :
Composé Pks
AgCl 9,75
AgBr 12,3
AgI 16,08
-Pour avoir la solubilité en g.L-1 il suffira de multiplié Pks par M(de l'espèce).
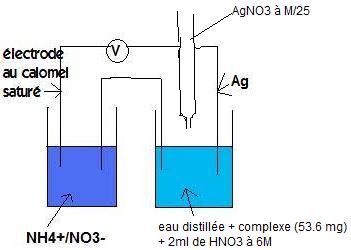
Manipulation : Placer dans un bécher de 100 ml le sel complexe mesurée et ajouté de l'eau jusqu'a qu'il soit au même niveau que le second bécher. Ajouter 2mL d'acide nitrique 6M. Effectuer le dosage en ajouter la solution de nitrate d'argent (M/25) par pas de 0,5 cm3 en relevant la fem à chaque fois. Ralentir lors de l'approche du saut (aller de 0,25 cm3
Questions :
-Montrer que la fem de cette pile est uniquement en fonction de la concentration en ion chlorure dans le bac de droite. Donner son expression littérale.
-A partir du Ve déterminer le nombre de moles d'ions e chlorure présents dans la solution et en déduire la masse d'ions de chlorure libérés lors de la dissolution du complexe
-Connaissant la masse de complexe pesée initialement ainsi que les masses molaires du complexe et d'un ion chlorure, écrire l'égalité reliant les masse déterminées expérimentalement aux masses molaires et au nombre d'ions chlorure non-coordinés.
On a pesée une masse de complexe de 53,6 mg soit 0,053 g. Et nous nous sommes arrêtés à 18,0 mL de AgNO3 ajouté.
Je vous met le tableau dans peu de temps il faut que je demande à mon binôme.
Pour les formules notre professeurs nous à donné une piste, la formule que l'on doit trouvé peut être une des trois ci-dessous :
[Co(NH3)5Cl2]Cl
[(NH3)5Cl]Cl2
[Co(NH3)5]Cl3
J'ajoute les masses molaires du Cl-=35,4 g.mol.L-1
J'admet que pour cette partie j'ai flanché :s
Bonjour,
Je n'ai pas le temps pour l'instant de répondre à toutes les questions dans le détail.
Juste quelques erreurs que j'ai remarquées.
1) L'activité d'un solide vaut 1 quelle qu'en soit la quantité. La notation [Ag] n'a pas de sens physique, pas plus que la phrase :"On va négliger Ag+ en supposant que Ag>>Ag+ "
2) Compte tenu de la relation de Nernst, il vaudrait mieux tracer la courbe E = f(log[Ag+] plutôt que la courbe E = f([Ag+]
3) la différence de deux log est le log du quotient, pas le log de la différence !
Autre problème éventuel : dans ce TP, au moins pour la première partie, tu mesures sans doute la différence de potentiel entre ton électrode en argent et une électrode de référence au calomel saturé.
Dans ce cas, tu mesures  E=EAg+/Ag - Eref où Eref est le potentiel de l'électrode au calomel saturé , valeur qui a due t'être donnée (valeur proche de 248mV). La demie réaction intervenant dans la demie pile au calomel saturée n'est pas celle que tu indiques...
E=EAg+/Ag - Eref où Eref est le potentiel de l'électrode au calomel saturé , valeur qui a due t'être donnée (valeur proche de 248mV). La demie réaction intervenant dans la demie pile au calomel saturée n'est pas celle que tu indiques...
En fait mon graphique est je pense juste mais mal annoté. Regarder l'annexe j'ai tous près calculé. Donc c'est ma notation qui est fausse ?
Oh oui oh mon dieu la bêtise oui ^^".
Donc dans toutes mes expressions à la place de E(g) je remplace par E(ref). Et nous avons en effet eut un tableau qui nous donnait la valeur en mV de l'électrode de référence pour certaines température. Sachant qu'on était dans la salle à 18°c notre E(ref) doit valoir entre 253.9 et 247.7 mA.
Pour les log je me suis tromper dans la formule en + c'est vraiment pas ma journée ^^".
[...](ln
[...](ln(Ox(d)*Red(g)-ln(Red(d)*Ox(d))
[...](ln(Ox(d)-ln(Red(g)-ln(Red(d)-ln(Ox(d))
La seconde mesure paraît erronée. La droite moyenne a pour équation :
 E=0,548+0,050.log([Ag+])
E=0,548+0,050.log([Ag+])
à 18°C, le coefficient directeur théorique vaut : 0,058V : 16% d'écart environ : résultat assez moyen...
E°Ag+/Ag-Eref = 548mV
Avec Eref=248mV cela conduit à : E°Ag+/Ag=796mV ce qui correspond à moins de 1% près à la valeur donnée par les tables : résultat excellent !
Tu as un point de la courbe pas vraiment aligné avec les autres. Pour le reste, c'est un compliment effectivement ! A part la mesure pour ce point, le reste de la manip a dû être effectué de manière soignée ! Bravo !
Pour les solubilités j'ai trouvé :
AgCl
Kt = =
Néanmoins de je n'ai pas [Ag+] et même si je l'avais j'aurais pas la concentration de [Cl-]. A part si je dis qu'on est à l'équivalence..

J'ai finis les deux parties. J'aurais besoin d'aide pour la dernière partie avec le sel complexe s'il vous plaît :'(
Bonsoir,
Pour l'expérience n° 2 sur les produits de solubilité, la tension mesurée est :
En supposant la solution saturée (présence de précipité) on a :
(Ks : produit de solubilité)
La concentration initiale en ions argent étant très faible devant celle en ions chlorure, la quantité d'ions chlorure qui disparaît pour former le précipité est très faible devant la quantité initiale d'ions chlorure : [Cl-] c : concentration de la solution en chlorure de potassium KCl. Donc :
c : concentration de la solution en chlorure de potassium KCl. Donc :
A vous avez réutilisé la formule donnée par la droite... Mais le produit de solubilité dans mon tp met donnée comme ceci :
Kt = =
. Alors je ne comprends pas on devrais reprendre l'équation de Nernst. Est qu'on peut considérer que KCl = Cl- et que donc il vaut 10E-1 ?
A en fait, vous avez expliqué pourquoi on avait le droit de dire justement que Kcl = Cl- ( c'est ce que j'ai cru comprendre) . Et oui bonsoir (qu'elle mauvaise garçon je fais ^^")
Est qu'on peut considérer que KCl = Cl- et que donc il vaut 10E-1 ?
Comme je l'ai justifiée précédemment, tu peux écrire que la concentration en Cl- est la quantité de KCl dissoute par litre soit 0,1mol/L mais tes notations sont très maladroites...
Il y a une erreur dans ta définition du produit de solubilité : le "plus" au dénominateur doit être remplacé par un"multiplié" : je t'ai indiqué plus haut la définition de Ks dans le cas du chlorure d'argent.
J'avais mis multiplier :S latex me fait encore des tours. Est ce que je vous fournis mes résultats pour la partie solubilité ?
Dans le doute je vous les glisses ici : index
E représente la f.e.m mesuré. A chaque montage avec les différentes solutions
E représente le
 E de la formule que j'ai indiquée précédemment ??
E de la formule que j'ai indiquée précédemment ??Bonsoir,
En utilisant, la relation que je t'ai fournie hier à 17h05, ton tableau conduit à :
La valeur habituellement fournie par les tables (9,75) est un peu plus faible mais ta mesure n'est pas catastrophique...
Donc le mieux est de réutilisé l'équation de la droite pour trouver le Ks ? Je ne comprends pas très bien le rôle de chaque composant de cette équation de droite :/
Donc le mieux est de réutilisé l'équation de la droite pour trouver le Ks ? Je ne comprends pas très bien le rôle de chaque composant de cette équation de droite :/
Pas du tout ! utilise le tableau de mesures fourni le 06-12-15 à 18:08 et mon raisonnement du 06-12-15 à 17:05. J'ai juste appelé
 E et non E le résultat de tes mesures puisqu'il s'agit en fait de différences entre le potentiel de ton électrode de mesure en argent et ton électrode de référence au calomel.
E et non E le résultat de tes mesures puisqu'il s'agit en fait de différences entre le potentiel de ton électrode de mesure en argent et ton électrode de référence au calomel.
J'ai pris ta valeur
 E=6mV pour déterminer la valeur du pKs de AgCl
E=6mV pour déterminer la valeur du pKs de AgClDu coup ma solubilité en mol/L est fausse dans mon tableau. Par exemple pour AgCl 4.08E-10.
D'ailleurs pour votre équation au début on utilisait
 E=0,548+0,050.log([Ag+])
E=0,548+0,050.log([Ag+])
et pour la solubilité :
 E=EAg+/Ag+0,058.Log[Ag]+-Eref
E=EAg+/Ag+0,058.Log[Ag]+-Eref
Comment l'avez vous trouvé ? ? ?
Je m'excuse du retard je passais mes partiels ^^". De plus je viens de remarquer, comment avez vous trouvé la valeur de la ref à 248mV ?
Bonsoir,
La valeur du potentiel de l'électrode de référence au calomel, mesuré par rapport au potentiel de l'électrode standard à hydrogène, est fournie par le constructeur (Tacussel ou autre). On peut aussi la retrouver à partir des tables thermodynamiques si on connait précisément les concentrations utilisées. C'est pour cela que j'avais précisé dans un message précédent que la valeur 248mV est une valeur possible, pas nécessairement celle correspondant exactement au matériel que tu as utilisé...
de ce fait je fixe une valeur arbitraire alors. Et s'il vous plaît concernant l'expression de la concentration de [Ag+] est ce que ma formule est correcte ?
Bonjour,
est ce que ma formule est correcte ?
Oui mais tu te compliques beaucoup la vie :
Pour tout x positif :
Compte tenu de la température de l'expérience que tu as indiquée au départ.
Tu as sûrement vu en cours qu'à 25°C :
le résultat étant exprimé en volts.
Le passage au logarithme décimal simplifie souvent les calculs.