Inscription / Connexion Nouveau Sujet
Physiologie cellulaire - potentiel chimique
Bonsoir,
Je peine à comprendre le concept de potentiel chimique en l'imageant. Je sais qu'il s'agit d'un changement de l'Energie de Gibbs / mole de la particule.
Toutefois, ça me semble plutôt "abstrait" et j'ai du mal à saisir son importance dans les notions telle que l'osmose.
Si quelqu'un pourrait m'expliquer ce que c'est de manière à ce que je puisse intuitivement intégrer le concept, ça serait génial 
Merci d'avance
Bonsoir nou366,
Comme les transformations que nous étudions ont en général lieu à (T; p) fixées, la définition à partir de l'enthalpie libre est plus pratique et aussi plus parlante.
Considérons un système constitué de plusieurs espèces, par exemple un mélange d'eau et d'éthanol liquide, à T et p fixées. Si on ajoute à ce mélange une petite quantité d'eau, faisant varier ainsi la quantité de matière d'eau de , l'enthalpie libre du système varie de :
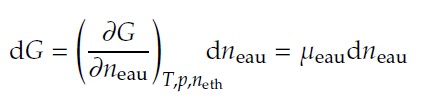
Autrement dit, mesure la variation d'enthalpie libre d'un mélange d'eau et d'éthanol suite à l'ajout d'une petite quantité d'eau. En effet, ajouter quelques molécules d'eau à ce mélange modifie les interactions au sein du système, et donc son énergie interne et son enthalpie, ainsi que l'organisation possible du système à l'échelle moléculaire et donc son entropie. Cette modification de l'enthalpie libre n'est pas la même selon la composition du système : si on ajoute quelques molécules d'eau à un mélange très pauvre en eau (par exemple un mélange de fraction molaire
), on se doute que les interactions intermoléculaires et l'entropie du système ne seront pas affectées de la même façon que pour le mélange équimolaire (à
).
J'espère que cela répond à tes interrogations.
Bonsoir
Tu as sans doute étudié un peu l'électricité au cours de tes études. Tu as appris que, à travers un dipôle passif, le courant circule spontanément de la borne où le potentiel est le plus grand vers la borne où le potentiel est le plus bas. C'est en pensant à cela que le nom "potentiel chimique" à été inventé. Il permet de prévoir (entre autres choses) les sens spontanés de transfert de matière. Je prends deux exemples simples.
1° imagine un verre contenant de l'eau à l'état liquide et de l'eau à l'état solide (glace). Suppose que les conditions de température et de pression sont telles que le potentiel chimique de la glace est supérieur au potentiel chimique du liquide : spontanément la glace va fondre : des molécules d'eau passent de la phase de potentiel chimique élevé vers la phase de potentiel chimique faible.
2° imagine maintenant un soluté "A" présent dans deux solutions séparées par une paroi poreuse. "A" vas spontanément traverser la membrane de la solution où son potentiel chimique est le plus grand vers la solution où son potentiel chimique est le plus faible.
Maintenant, si tu cherches quelque chose de plus théorique, la situation se complique. Pour bien s'en sortir, il faut avoir bien compris la notion de grandeur molaire partielle : en effet, le potentiel chimique se définit comme l'enthalpie libre molaire partielle.
Je te fournis un document assez complet sur le sujet mais probablement d'un niveau plus important que ce qui te sera utile. Je te conseille tout de même la partie II.5 qui définit certaines notions susceptibles de t'être utiles.
![]()


