Inscription / Connexion Nouveau Sujet
pH solution
Bonjour,
je dois calculer le pH d'une solution de de
,
,
.
Cependant je ne vois pas du tout comment faire ...
Ne me manque-t-il par une information ? (la concentration?)
Merci de votre aide
^^
Bonsoir
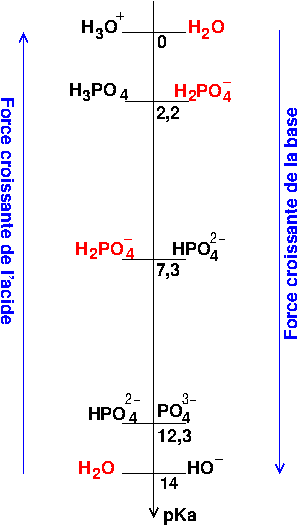
On peut se passer de la concentration à condition de supposer qu'elle est nettement supérieure à 10-7mol/L de façon à négliger l'influence de l'autoprotolyse de l'eau. Dans ce cas je te laisse réfléchir et trouver la réaction prépondérante. Tu en deduiras un pH égal à la moyenne de deux pKa.
Pour aider, quelques indications sur la recherche de la réaction prépondérante.
1° : classer les couples acide-base en fonction de leurs pKa ;
2° : savoir qu'une réaction acide/base fait intervenir l'acide d'un couple avec la base d'un autre couple ;
3° : la réaction prépondérante ne peut faire intervenir comme réactifs qu'un acide et une base initialement présents en quantités non négligeables (celles écrites en rouge sur le diagramme) ;
4° : la réaction prépondérante se fait entre l'acide le plus fort et la base la plus forte ;
5° : cette réaction est effectivement prépondérante que si sa constante d'équilibre est nettement supérieure aux constantes d'équilibre des autres réactions acide-base envisageables.
Deux remarques pour aider à la comparaison des constantes d'équilibre :
1° : Si la réaction envisagée respecte la règle du "gamma", la constante d'équilibre est supérieure à 1 et d'autant plus élevée que l'écart entre les pKa des deux couples est grand. Cette remarque concerne essentiellement les réactions de dosage, hors sujet dans cet exercice.
2° : Si la réaction envisagée ne respecte pas la règle du "gamma", sa constante d'équilibre est inférieure à 1 mais d'autant plus proche de 1 (d'autant plus grande) que l'écart de pKa est faible. C'est la situation de cet exercice.