Inscription / Connexion Nouveau Sujet
pH-métrie (solutions tampons)
Bonjour,
J'ai réalisé un TP qui concerne la pH-métrie et plus particulièrement l'étude de solutions tampons. J'ai quelques questions qui me sont posés et je dois dire que je bien bloquée depuis un moment dessus.
Alors voilà :
J'ai préparé une première solution tampon qui contient 50 mL d'acide acétique (0.50 mol/L) et 50 mL d'acétate de potassium (0.50 mol/L).
Je prélève ensuite 20 mL de cette solution que je place dans un bécher, puis j'ajoute 10 mL de solution HCL (0.10 mol/L), enfin je complète à 100 mL d'eau.
On me demande alors :
- Ecrire les équations de réactions et le tableau d'avancement pour cette solution
- Calculer les nombres de mole et les concentrations d'acétate et d'acide acétique
- Calculer le pH théorique
Donc je ne sais pas mais ces questions me bloquent carrément, je n'arrive pas a écrire les équations et ducoup impossible d'avancer.
J'avais une première piste ou j'ai écris : CH3COOH + OH- -> CH3COOk + H20
et je sais que pour HCL c'est : HCL + H20 -> CL- + H+
Si quelqu'un veut bien m'éclairer...
Merci par avance.
Bonjour
Réfléchis à la réaction prépondérante quasi totale qui se produit lors de l'ajout de l'acide fort. Tableau d'avancement...
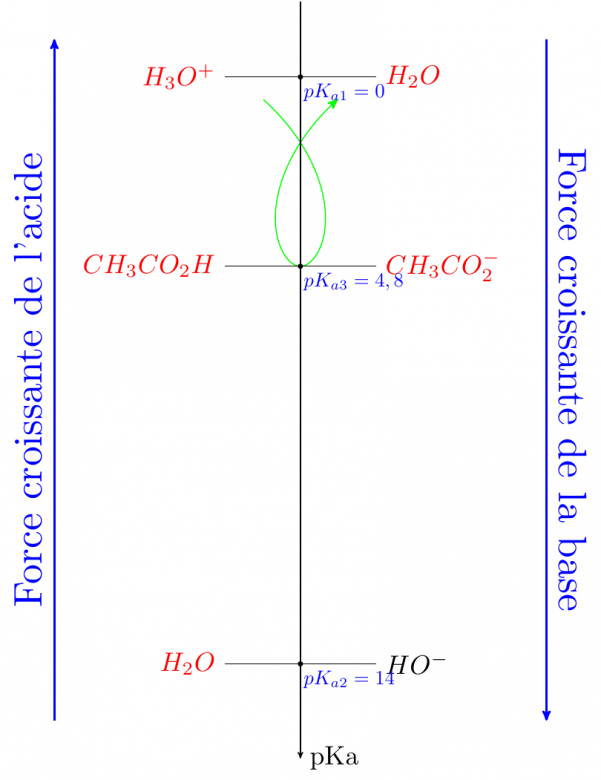
La réaction prépondérante fait intervenir l'acide le plus fort et la base la plus forte en présence à condition qu'il ne s'agisse pas d'espèces ultraminoritaires.
Je vois bien que l'acide le plus fort ça sera HCL mais pour la base... KOH ?
Je n'arrive pas à comprendre comment se traduit la réaction entre mes deux réactions en terme d'équation
HCl n'existe pas en solution car c'est un acide fort qui réagit de façon totale sur l'eau selon la réaction dont tu as fourni l'équation. L'acide fort est donc l'ion H3O+
Il y a des ions hydroxyde fournis par l'autoprotolyse de l'eau mais ils sont ultraminoritaires ici.
Reste donc comme base, les ions éthanoate...
D'accord don si j'ai bien compris, j'ai H30+ mon acide fort qui va réagir avec ma base forte CH3CO2-
Donc j'aurai comme équation : H3O+ + CH3CO2- = CH3CO2H + H20 ?
Oui pour l'équation mais l'ion éthanoate n'est pas une base forte. Tu peux remplir maintenant un tableau d'avancement puis utiliser le relation bien connue :