Inscription / Connexion Nouveau Sujet
pH métrie
bonjour,
j'ai un exercice type concours à faire et quelques questions me posent problème :
voici l'énoncé :
Les produits d'entretient appelées pH+ permettent d'augmenter le pH de l'eau du SPA. Il existe différentes compositions, l'une d'elle est composée de NaCO3.
Les notices indiquent qu'il faut ajouter 10g de carbonate de sodium par m3 d'eau pour faire augmenter le pH de 0,1 unité.
On considère une eau dont le pH vaut 6,8 et qu'on souhaite remonter à 7,2 et le TAC initial vaut 15°F (volume en mL de solution aqueuse d'HCl à 0,020mol.L-1 qu'il faut ajouter à 100mL d'eau en présence d'hélianthine)
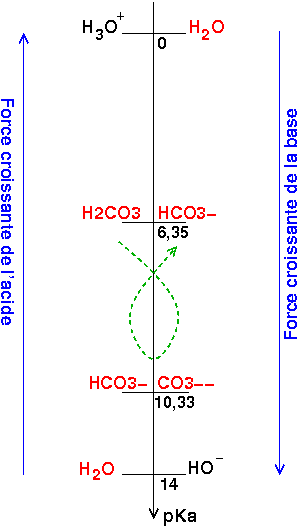
1) calculer les concentrations en H2CO3, CO3(2-) et HCO3(-)
J'ai trouvé respectivement 0,0012, 9,49.10-3 et 0,0030 mol.L-1 grâce à la valeur du TAC et aux constantes d'équilibre
2) écrire l'équation bilan lors de l'ajout des ions carbonates dans l'eau
J'ai écris : Na+ + CO2- 3 + 2H3O+ -> H2CO3 + 2H20 + 2Na+
La constante c'est donc 1/(Ka1*Ka2) Ka1 et Ka2 étant les constantes des couples du carbonate dans l'eau
Je trouve que la réaction est totale.
et c'est à partir de là que je n'ai aucune piste :
3)Déterminer les concentrations des espèces après l'ajout de carbonate de sodium
4) calculer le pH de la solution après l'ajout
5)en déduire le TAC de l'eau après l'ajout
Je sais qu'il faut ajouter 40g de carbonate pour passer d'un pH de 6,8 à 7,2 soit 0,48 moles ... mais ensuite je ne sais pas ...
merci d'avance
Bonjour
Revois bien tes domaines de prédominance en fonction du pH et des pKa. Le pH est proche de pKa1. [H2CO3] et [HCO3-] doivent être du même ordre de grandeur. Tes résultats sont cohérents. En revanche, le pH est très inférieure à pKa2. Les ions carbonate sont donc ici ultraminoritaires. J'obtiens personnellement une concentration de l'ordre de 9.10-7mol/L
Pour la réaction prédominante lors de l'ajout de carbonate de sodium Na2CO3 (tu as oublié le "2"), il faut envisager une réaction entre les ions carbonate et des espèces présentes en quantité non négligeable. Or les ions oxonium sont ultraminoritaire à pH voisin de 7. Il faut donc envisager la réaction des ions carbonate sur l'eau pour produire des ions hydroxyde et des ions hydrogénocarbonate. A pH très inférieur à pKa2, cette réaction peut être considérée comme quasi totale.
merci pour votre réponse !
j'avais bien ce 10-7, je me suis trompée en recopiant.
J'ai donc bien recalculer ma constante et trouve une constante très petite, ce qui rend cette réaction peu favorisée.
Est ce que pour la suite de mon exercice je peux considérer seulement le premier équilibre mettant en jeu CO2-3 et HCO3- ( donc on faisant l'hypothèse que la concentration en H2CO3 ne varie pas) ?
L'ajout de carbonate de sodium conduit à la réaction :
A pH voisin de 7 cette réaction est quasi totale car le pH est très inférieur à pKa2. Tu as sûrement vu en cours qu'une base ou un acide faible peut avoir un taux de réaction sur l'eau très proche de 100% en cas de concentration très faible, ce qui est le cas ici. La situation est compliquée pour deux raisons :
1° : une partie (environ 50% car pH proche de pKa1) des ions hydrogénocarbonate réagit sur l'eau :
2° : à pH voisin de 7 l'autoprotolyse de l'eau doit être prise en compte. Bref : je pense qu'il est préférable de raisonner sur la conservation des éléments chimiques et l'électro-neutralité de la solution.
Pour simplifier, je suppose que l'électro-neutralité est assurée uniquement par des ions calcium spectateurs.
Récapitulatif des résultats obtenus à pH=6,8 avec pKa1=6,35 ; pKa2=10,33 :
Soit c la quantité de carbonate de sodium ajoutée par litre pour passer à pH=7,2.
Les c mole par litre d'ions carbonate se transforment de façon quasi totale soit en ions hydrogénocarbonate soit en acide carbonique :
Relation d'électro-neutralité de la solution :
En négligeant les ions ultra minoritaires :
En reportant dans l'expression déjà obtenue :
Cette équation à une inconnue conduit à :
La masse molaire du carbonate de sodium étant M=106g/mol, la masse de cristaux à ajouter par m3 est :
Un peu plus que ce qu'annonce la notice mais attention : une échelle de pH est une échelle logarithmique, pas une échelle linéaire. Une telle indication ne peut qu'être grossièrement indicative.
Je te laisse terminer...
et sachant qu'ils me demandent la valeur du pH ensuite, je pense ne pas pouvoir utiliser la valeur de 10-7,2 pour la concentration en H3O+ ?
Une eau naturelle possède nécessairement des ions positifs spectateurs pour assurer l'électro-neutralité de la solution. Un TAC non nul s'explique souvent par la dissolution dans l'eau de carbonate de calcium, d'où la présence d'ions calcium mais on peu aussi trouver des ions potassium, sodium, etc .Si tu as une bouteille d'eau minérale à ta disposition, jette un coup d'il à l'étiquette. La nature de ces ions n'influence pas la résolution de ce problème.
La question 4 n'a aucun sens : par hypothèse, le pH a été relevé à la valeur 7,2 !
Oui c'est bien ce qui me semblait ! Merci beaucoup pour vos explications !
Pour la suite ils considèrent déjà une eau contenant les trois espèces du bicarbonate, je dois seulement faire la RP qui est la réaction entre le bicarbonate et l'hydrogénocarbonate qui donnent deux acides carbonique et considérer celle ci totale (avec une constante de 10000) pour trouver les concentrations ?
Je ne vois pas bien dans quels cas on peut utiliser la méthode "simple" de la RP et dans quels cas on doit utiliser l'électroneutralité...
Dans une situation un peu complexe, tu as tout intérêt à classer les couples acide/base en fonction de leurs pKa comme fait ci-dessous. Pour qu'une réaction entre un acide et une base puisse être considérée comme réaction prépondérante, il faut deux conditions :
1° la réaction doit se faire entre deux réactifs qui sont initialement en quantités non négligeables. Cette condition, souvent oubliée des étudiants, est indispensable, sinon la R.P. serait toujours :
D'où l'intérêt dans le tableau de marquer d'une manière ou d'une autre (souligner, écrire en rouge comme je l'ai fait...) ces espèces en quantités initiales non négligeables.
2° la R.P. doit avoir une constante d'équilibre nettement plus élevée (au moins 104 fois plus) que les autres. C'est le cas ici pour la réaction :
Une difficulté peut apparaître pour les pH proches de 7 : la réaction d'autoprotolyse de l'eau peut venir fausser les résultats comme indiquer dans mon message précédent. Cependant, la R.P. ne faisant intervenir ici ni les ions oxonium ni les ions hydroxyde, la méthode est applicable ici, ce que je n'ai pas fait précédemment. Si, comme précédemment, je note c la quantité de carbonate de sodium introduite par litre. Un rapide tableau d'avancement conduit à :
On obtient la même valeur que par la méthode précédente :
Pour résumer : la méthode de la R.P. est à choisir s'il existe effectivement une réaction prépondérante ayant les deux propriétés précédentes et si l'autoprotolyse de l'eau ne vient pas compliquer la situation. Elle est en général un peu plus rapide que la méthode « classique ».