Inscription / Connexion Nouveau Sujet
pH diacide
Bonjour à tous et merci du temps que vous m'accorderez.
Voilà l'énoncé:
Trouver le pH d'une solution d'acide oxalique à 0,1M. On donne pKa1=1,2 et pKa2=4,3.
Puis-je ignorer la deuxième acidité car la différence de pKa est supérieur à 2?
Parce que si oui je trouve un pH de 1,65.
Si ce n'est pas le cas il me semble que le pKa1 est très faible (COOH)2 n'agit-il pas comme un acide fort alors dans ce cas il faudrait considérer la deuxième acidité?
Bonjour
La simplification consistant à négliger la seconde acidité est correcte si elle conduit à un pH inférieur à pKa2 -1.
Cela semble le cas ici. En revanche j'obtiens une valeur de pH inférieure à la tienne.
Bonjour Vanoise et merci de revenir à ma rescousse.
Je détaille:
Ce qui nous donne:
de là on trouve directement h avec:
Mea culpa j'avais du faire une petite erreur 
Quand est-ce que la deuxième acidité n'est pas à négliger et par la même quel est le mode opératoire?
Bonjour
Négliger la seconde acidité revient à négliger la présence de A2-. Le pH ainsi calculé doit appartenir soit au domaine de prédominance de AH2 soit au domaine de prédominance de AH- ce qui correspond à un pH inférieur à pKa2 - 1.
Si le calcul correct que tu as fait avait conduit à un pH supérieur ,il aurait fallu envisager ta seconde hypothèse qui aurait été validé pour un pH supérieur à pKa1+1...
Si la première acidité est forte, elle profuit c mol/L de H3O+ et autant de AH-. En notant x l'avancement volumique de la réaction de AH- sur l'eau, tu obtiens:
[H3O+]=c+x
[AH-]=c-x
[A2-]=x
Le calcul de x à partir de pKa2 conduit à un pH incohérent avec l'hypothèse de départ.
En revanche, tu sais que la dilution augmente le taux de réaction de l'acide sur l'eau. L'hypothèse d'une première acidité forte serait sans doute correcte pour c=10-4mol/L.
Donc si je comprends bien, les cas ou je devrais utiliser la deuxième acidité:
-si la concentration initiale en acide est inférieure à 10^-3.
ou
-si le pH trouvé > pKa-1(ça je suis pas sûre)
Parfait!
Comme on se donne une marge de sécurité de une unité de pH de chaque côté de frontière, pouvoir négliger l'influence de la seconde acidité donc la présence de C2O42- suppose un pH inférieur à 3,3.
En revanche supposer la première acidité forte revient à négliger la présence de H2C2O4 donc à considérer le pH supérieur à 2,2.
Si tu as le temps fais le calcul. Tu vas trouver cette hypothèse incohérente pour c=0,1mol/L et cohérente pour c=0,0001mol/L
Alors j'ai refait les calculs:
-Pour une concentration à 0.1M:
-Pour une concentration à 0.001}M.
là pour la justification je sais pas trop

Je dirai qu'il est dans le pH est dans le domaine de prédominance?
Très bien!
Supposer la première acidité forte revient à négliger la présence de H2C2O4 ce qui correspond à un pH supérieur à 2,2. Ton dernier calcul de pH est cohérent.
Salut Vanoise.
Je sais pas si tu suis encore ce topic. J'ai refait cet exercice et en regardant la solution sur le site je vois qu'il trouve un pH de 1.27. Du coup je sais plus trop quoi penser,
Bonjour
ton message du 08-02-17 à 14:42 :
-Pour une concentration à 0.1M:
Calcul avec
Nous sommes donc d'accord avec le site dont tu parles pour c = 0,1mol/L !
Oh excuse oui je suis resté sur le 3,7.
Sans vouloir abusé j'ai encore une question. Si on trouve un pH entre 2,2 et 3,3 qu'en est-il? Peut-on a ce moment la parler de solution tampon?
Si on trouve un pH entre 2,2 et 3,3 qu'en est-il?
Dans ce cas, la réaction de l'acide oxalique a produit AH- de façon quasi totale et il est aussi possible de négliger la formation de A2- : le diacide se comporte alors comme un monoacide fort : pH
 -log(c)
-log(c)Peut-on a ce moment la parler de solution tampon?
Pour qu'une solution puisse être qualifiée de "tampon", il faut qu'elle ait les deux propriétés suivantes :
1° : le pH doit être pratiquement insensible à la dilution
2° : le pH doit être peu sensible à l'addition de petites quantités d'acide ou de base.
Imagine une solution équimolaire d'acide éthanoïque et d'éthanoate de sodium telle que : [CH3CO2H]=[CH3CO2-.
pH = pKa quelle que soit c sauf pour les solutions très diluée : la première propriété est vérifiée
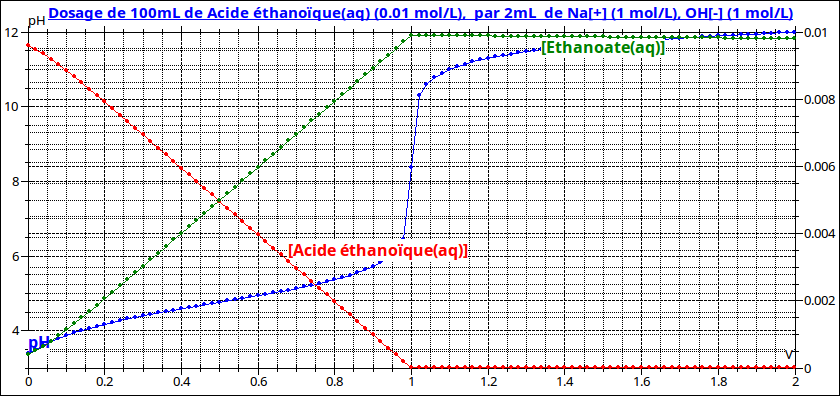
Ce mélange correspond à la demie équivalence lors d'un dosage de l'acide éthanoïque par la soude : la courbe pH=f(Vb) admet une pente très faible à la demie équivalence : la seconde propriété est vérifiée.
Imagine maintenant une solution d'hydrogénooxalate de sodium. On montre facilement que son pH vaut : ½ (pKa1+pKa2) ; il est indépendant de c : la première des deux propriétés est vérifiée.
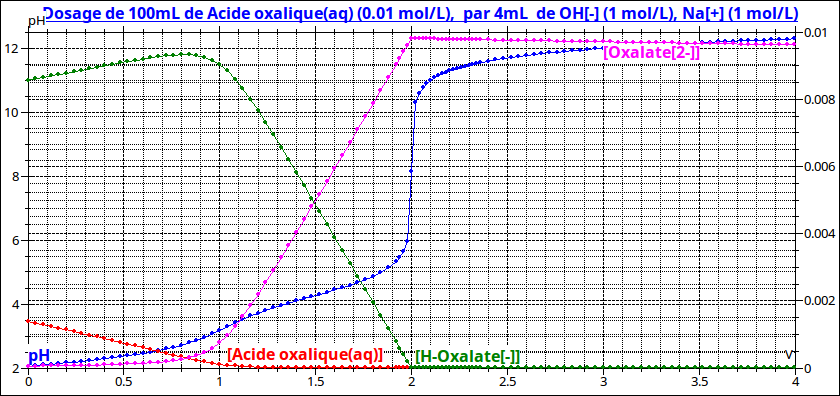
En revanche, cette solution correspond à la première équivalence du dosage de l'acide oxalique par la soude. A cette équivalence, le pH varie assez fortement en fonction du volume de soude ajoutée : la seconde propriété n'est pas vérifiée. La solution d'hydrogénooxalate de sodium n'est pas une solution tampon ; on parle parfois de pseudo tampon puisque une seule des deux propriétés est vérifiée.
Pour illustrer mon propos, voici les deux courbes de titrage évoquées. La différence serait encore plus nette si la différence des deux pKa était plus importante : cas de l'hydrogénocarbonate de sodium par exemple.