Inscription / Connexion Nouveau Sujet
pH
Bonjour
Je voudrais savoir si jai bon ici
Si jai un ampholyte + base Forte
Est ce que je dois appliquee la formule de pH base Forte ou amphothere
Selon moi base Forte mais je ne suis pas sur
Si par exemple jai aussi ampholyte + base faible alors dans ce cas je dois faire celle de base faible ?
Et ampholyte + sa base conjuguee japplique la formule de pH dun amphotere( pk1+pk2)/2
Bonsoir
Est ce que je dois appliquee la formule de pH base Forte
En pHmétrie encore plus qu'ailleurs en Sciences Physiques, il faut réfléchir à la situation au lieu de chercher qu'elle est la formule à appliquer. Pour bien orienter la réflexion, il faut commencer par classer les différents couples acide/base susceptible d'intervenir en fonction de leurs pKa puis se demander s'il n'y a pas par hasard une réaction prépondérante susceptible d'imposer le pH. Un tableau d'avancement permet alors d'obtenir assez facilement le résultat.
C'est donc une question de cas par cas...
Le plus souvent, un ampholyte réagit sur une base forte de façon quasi totale en se comportant comme un acide faible mais cela doit être vérifié à partir des pKa et des calculs de constantes d'équilibre.
En fait,
J'ai du H2A - et du OH- qui reagissent ensemble
Jai la concentration, volume du titrant et tires aussi mais la question du prof est quel est la formule de pH a appliquer sachant que le pka du H2A est compris entre 3,5 et 7,5
Cest donc un acide faible et OH- est une base Forte
Du coup la base Forte l'emporte et on applique la formule de pH de base Forte
Cest bien ca ?
Comme déjà dit, il faut raisonner au cas par cas ; il n'y a pas de formule "universelle" simple.
Pour une explication précise, il faudrait un énoncé complet.
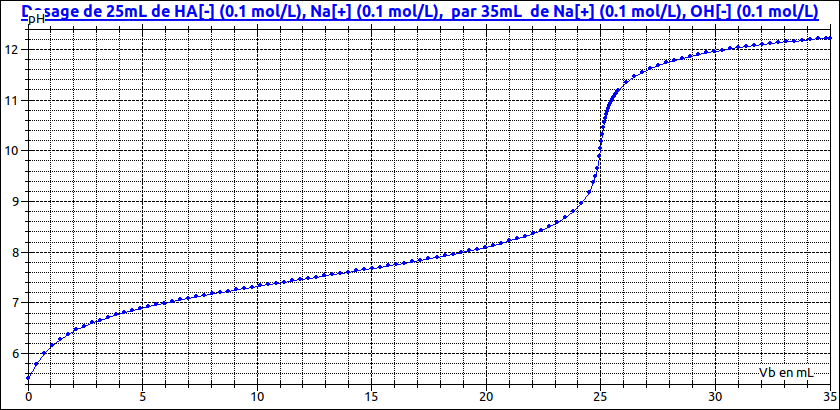
On a un titrage de 25mL dune solution qui contient du NaHA (3,5<pka <7,5) a une concentration de 0,1 molaire avec du chlorure de sodium 0,1 molaire
Quel est la formule de pH que vous utiliserez si on ajoute 30 mL de titrant
Tu as la réaction de dosage quasi totale entre l'ampholyte HA- et les ions hydroxyde de l'hydroxyde de sodium :
HA- + HO- = A2- + H2O
Le volume équivalent de soude est Vbe=25mL. Les ions hydroxyde ajoutés après l'équivalence restent en solution sans réagir et impose le pH. Tu calcules celui-ci comme le pH d'une solution de base forte de concentration :
Tu vérifie au final que le pH obtenu est supérieur à 8,5 et appartient bien au domaine de prédominance de A2-.
Mais selon le prof on ne doit pas appliquer la formule de pH base forte( cest faux pour lui)
Est ce une erreur de sa part?
Est ce une erreur de sa part?
Le calcul que je t'ai fourni et la "formule" valide pour une base forte conduit à :
pH=11,96
 12,0
12,0
Le logiciel de simulation réputé fiable que j'ai aussi utilisé et qui effectue le calcul complet conduit à pH=12,0...
Le pH calculée en faisant l'hypothèse d'une base forte est largement supérieur à 8,5.Cela signifie que A-- est l'espèce prédominante et sa présence n'influence le pH que de façon négligeable.