Inscription / Connexion Nouveau Sujet
Ph
Bonjour, je ne comprends pas comment le prof a determiner les valeurs des activités de h3o+ et celle de oh- a partir de la valeur de force ionique sachant que cette derniere vaut 1/2 fois la somme du produit des concentrations et du carry des charges dions dans l'énoncé que voici
Calculer le pH et la concentration en H+ dans une solution contenant du LiBr dont la concentration = 0,05M
Merci davance

Bonjour
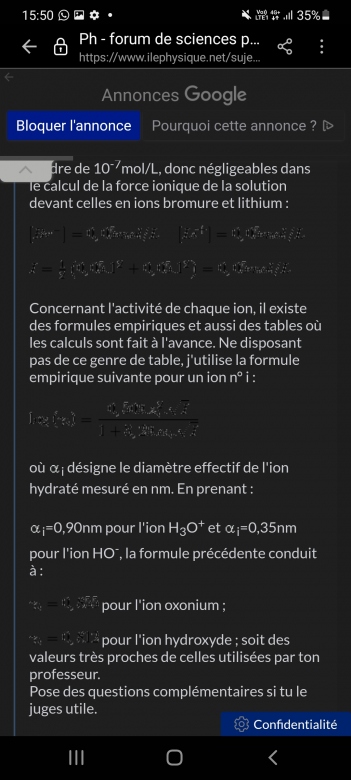
Les ions lithium et bromure étant spectateurs, le pH est voisin de 7, les concentrations en ions oxonium et hydroxyde sont donc de l'ordre de 10-7mol/L, donc négligeables dans le calcul de la force ionique de la solution devant celles en ions bromure et lithium :
Concernant l'activité de chaque ion, il existe des formules empiriques et aussi des tables où les calculs sont fait à l'avance. Ne disposant pas de ce genre de table, j'utilise la formule empirique suivante pour un ion n° i :
où  i désigne le diamètre effectif de l'ion hydraté mesuré en nm. En prenant :
i désigne le diamètre effectif de l'ion hydraté mesuré en nm. En prenant :
 i=0,90nm pour l'ion H3O+ et
i=0,90nm pour l'ion H3O+ et  i=0,35nm pour l'ion HO-, la formule précédente conduit à :
i=0,35nm pour l'ion HO-, la formule précédente conduit à :
pour l'ion oxonium ;
pour l'ion hydroxyde ; soit des valeurs très proches de celles utilisées par ton professeur.
Pose des questions complémentaires si tu le juges utile.
Tu veux dire que les formules utilisant l'éditeur d'équations ne ressortent pas sur ton portable ? Curieux : tout marche correctement chez moi, y compris sur mon téléphone portable. A titre de dépannage, je te fournis ma réponse au format pdf.

PDF - 80 Ko
Bonsoir à vous deux,
@ Selimhabibi : je te rappelle qu'il faut recopier ses pistes sur le forum :
 extrait de
extrait de Q05 - Puis-je insérer une image dans mon message ? Comment faire ? Quelle image est autorisée ?
Et que tu as tous les utilitaires pour ça :
 extrait de
extrait de Q10 - Puis-je insérer des symboles mathématiques afin de faciliter la lecture de mon message ?

En me relisant, je viens de remarquer que j'ai oublier un signe "-" devant l'expression du logarithme de  i :
i :
Bonjour,
Merci pour ta reponse vanoise cependant, je ne comprends pas pourquoi le produit ionique = activite de h3o+ fois concentration de H3O+ fois concentration de OH- fois activite de OH- or produit ionique = concentration de H3O+ fois Conc de OH-
Je ne comprends pas pourquoi 0concentration de H3O+ = conc de h3o+ fois activité de h3o+
Merci davance
Non : en toute rigueur, les constantes d'équilibre en général et le produit ionique de l'eau en particulier font intervenir les activités. C'est uniquement lorsque les solutions sont très diluées qu'il est possible de considérer que l'activité est numériquement très peu différente de la concentration mesurée en mol/L.

 guide latex
guide latex présent sous la zone de saisie du message. La liste complète des caractères mathématiques est disponible dans le
présent sous la zone de saisie du message. La liste complète des caractères mathématiques est disponible dans le  mode d'emploi du forum
mode d'emploi du forum
