Inscription / Connexion Nouveau Sujet
Permanente à froid (ox-réd)
Bonjour,
J'ai un exercice avec sa correction mais il y a certains points de la correction que je ne comprends pas.
Les thiols RSH et les thiolates RS- peuvent être facilement oxydés en disulfure RS__SR. En milieu biologique, l'oxydation de la fonction thiol de la cystéine conduit ainsi à un pont disulfure formant la cystine. Lors d'une permanente à froid, la solution commerciale utilisée permet dans un premier temps de rompre les ponts disulfure de la cystine puis dans un second temps de les reformer afin d'obtenir une chevelure bouclée.
La législation française impose une concentration maximale de 8% en masse pour l'acide thioglycolique noté RSH présent dans les solutions pour les "permanentes" à froid. On se propose ici de doser RSH par iodométrie. Les espèces considérées sont les espèces solubles RS__SR, RSH er RS- pour les espèces souffrées et IO3-, I3- et I- pour l'iode.
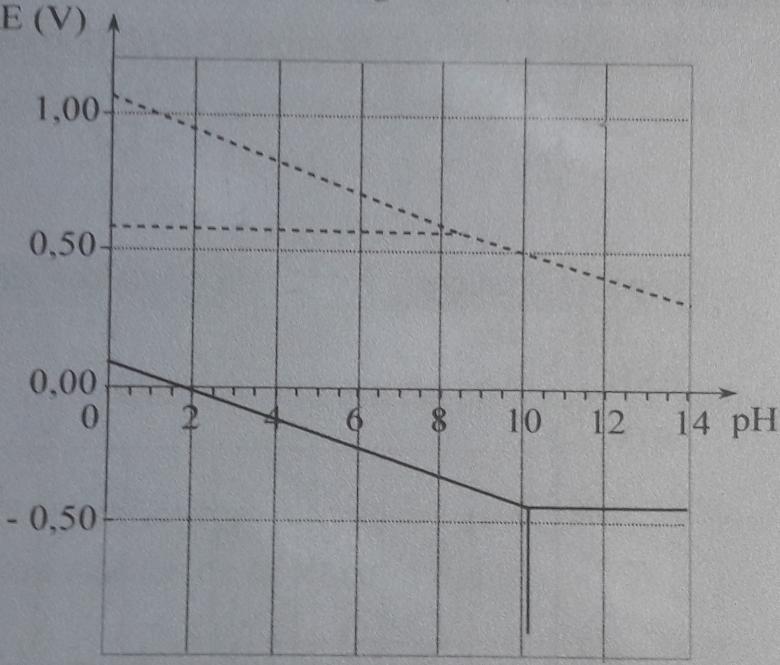
Les diagrammes potentiel-pH simplifié des éléments soufre (en trait plein) et iode (en pointillés) sont donnés ci-dessous (cf image), avec la convention suivante : chaque espèce dissoute a une concentration égale à 1,0.10-1mol.L-1.
Pour doser RSH par iodométrie, le protocole expérimental est le suivant :
-étape 1 : dans un volume V1=20,0mL de solution d'iodate de potassium de concentration C1=1,50.10-2mol.L-1, on ajoute un large excès d'iodure de potassium, puis quelque mL d'acide sulfurique concentré. On observe une coloration brune intense.
-étape 2 : on introduit alors mo=1,20g de solution commerciale pour permanente à froid. On laisse sous agitation pendant quelque minutes.
-étape 3 : on effectue le titrage de la solution résultante par une oluction de thiosulfate de sodium à C2=1,00.10-1mol.L-1 en présence d'empois d'amidon. Le virage de l'indicateur est obtenu pour un volume de thiosulfate versé Veq=10,8mL.
Les ions thiosulfates sont les réducteurs associées aux ions tétrathionate S4O62-.
Ce qui est écrit dans la correction et ce que je ne comprends pas :
Pour l'étape 1, on a IO3-+6H++8I-=3I3-+3H2O
(ici j'ai bien compris)
Pour l'étape 2, il y a écrit qu'on obtient :
I3-+2RSH=RS__SR+2H++3I-
QUESTION 1 : Ce que je ne comprends pas, c'est comment on sait que c'est I3- qui intervient dans cette équation bilan. Dans l'énoncé, on dit qu'on met I- en excès et de plus, on n'a aucune information sur le sens de la réaction et sur le fait qu'elle soit totale ou non. Du coup, pourquoi il ne resterait pas du I- et du IO3- qui pourrait intervenir dans l'équation bilan de la 2e étape? Est-ce qu'on néglige les quantités de IO3- et I- devant I3- ? Si oui, pourquoi on a le droit de faire ça?
QUESTION 2 : Pour l'étape 3, il y a écrit dans la correction qu'il y a un excès de I3- et qu'on le dose dans cette étape. Pourtant, d'après l'énoncé, je croyais qu'il y avait un excès de I-. Est-ce que cela provoque un excès de I3- ? Pourquoi ?
QUESTION 3 : Enfin, il y a écrit dans la correction que la quantité de matière de I3- totale, produite lors de la réaction de l'étape 1 est ntot(I3-)=3n(IO3-) mais je ne vois vraiment pas comment on trouve cette égalité........
Merci d'avance pour votre aide !
Bonjour
Question 1 : I- a le n.o. le plus faible des espèces contenant l'élément iode. Il ne peut ici agir que comme réducteur. Il ne peut donc pas oxyder RSH ; cela apparaît d'ailleurs dans ton diagramme de Pourbaix. Lorsque les domaines de prédominance de deux espèces admettent un domaine commun, ces deux espèces ne peuvent réagir l'une sur l'autre de façon significative.
En revanche I3- et IO3- sont des oxydants qui sont tous deux susceptibles de réagir de façon quasi totale sur RSH car leurs domaines de prédominance sont disjoints. Seulement l'énoncé précise que, à l'étape 1, I- est introduit en large excès : en fin d'étape 1, il n'y a plus d'ions iodate donc...
Question 2 : je pense qu'il faut comprendre que la quantité de I3- en début d'étape 2 est supérieure à deux fois la quantité de RSH.
Question 3 : regarde les coefficients stchiométriques de l'équation de l'étape 1.
Bonsoir,
Pour l'étape 1 :
Seulement l'énoncé précise que, à l'étape 1, I- est introduit en large excès : en fin d'étape 1, il n'y a plus d'ions iodate donc...
Cela signifie que la réaction de l'étape 1 est quantitative ? Comment peut-on le savoir ?
Pour l'étape 2 : ok mais ça reste flou quand même
Pour l'étape 3 : comment peut-on savoir que les conditions stoechiométriques sont réalisées pour l'étape 1 ?
bonsoir
Cela signifie que la réaction de l'étape 1 est quantitative ? Comment peut-on le savoir ?
Les domaines de prédominance de l'oxydant et le domaine de prédominance du réducteur n'ont pas de partie commune. Au fait : as-tu bien compris comment remplir le diagramme potentiel-pH en attribuant à chaque espèce son domaine de prédominance ?
Pour l'étape 2 : ok mais ça reste flou quand même
Si tu n'es pas convaincue, remplis un tableau d'avancement sachant que la réaction est quantitative.
Pour l'étape 3 : comment peut-on savoir que les conditions stchiométriques sont réalisées pour l'étape 1 ?
Tu n'as pas bien compris ; pour l'étape 1 : la réaction est quantitative et les ions iodate constituent le réactif limitant puisque les ions iodure sont en large excès.
Pour l'étape 1 : ce que je ne comprends pas c'est comment on sait que la réaction de l'étape 1 est quantitative parce-que d'après tes explications, j'avais compris que c'était ça qui permettait de savoir quelle est l'espèce entre IO3- et I3- qui oxyde RSH puisque les deux sont susceptibles de l'oxyder.
Pour l'étape 2 : pourquoi la réaction de l'étape 2 est également quantitative ?
Pour l'étape 3 : si l'étape 1 est quantitative j'ai compris
L'étape 1 a pour réactifs IO3- et I- ; puisque IO3- est le réactif limitant, il ne reste plus de IO3- en fin d'étape 1. L'étape 2 fait donc nécessairement réagir I3- comme oxydant puisque l'autre oxydant possible est absent !
Une réaction d'oxydo réduction fait nécessairement réagir un oxydant d'un couple sur le réducteur d'un autre couple. Propriété importante (je dirais même fondamentale) des diagrammes potentiel-pH : la réaction est quantitative si les deux réactifs ont leurs domaines de prédominance disjoints.
Je me demande si tu as eu un cours bien structuré sur les diagrammes potentiel-pH...
Tout mon problème vient en effet du fait que je ne savais pas que la réaction était quantitative si les deux réactifs avaient des domaines de prédominance disjoints. Merci pour cette info  Mon cours sur les diagrammes potentiel pH me semble assez bien mais peut-être que le prof a oublié de préciser ce point. J'espère que c'est le seul en tout cas...
Mon cours sur les diagrammes potentiel pH me semble assez bien mais peut-être que le prof a oublié de préciser ce point. J'espère que c'est le seul en tout cas...


