Inscription / Connexion Nouveau Sujet
Orbitales
 etudiantilois
etudiantiloisBonsoir,
Je me suis rendu compte avec les exercices que j'ai postés précédemment (les structures de la matière 1, 2, 3) que je n'ai pas bien compris la notion d'orbitales atomiques, de longueur de liaison, d'angle de liaison...
Pourriez-vous m'expliquer cela svp ?
Voici ci-dessous un extrait de mon cours, je trouve cela très abstrait...
Merci beaucoup par avance pour l'aide.
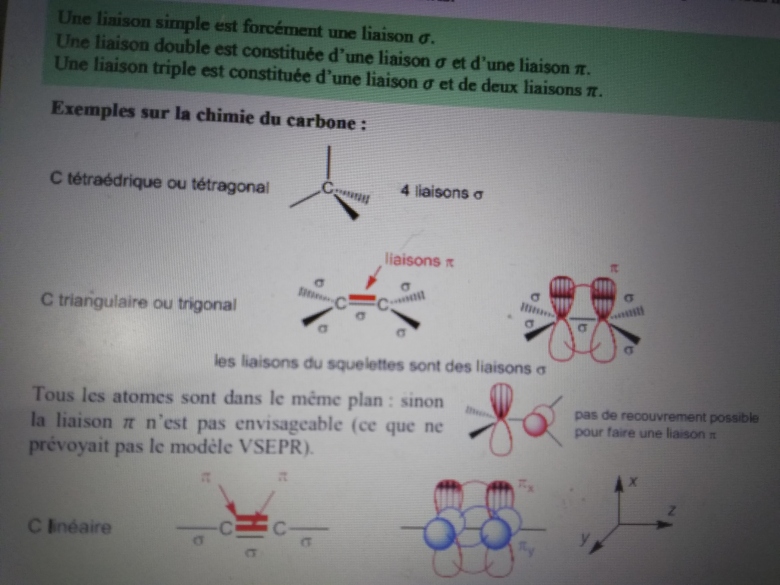
Partie 1 que je ne comprends pas :
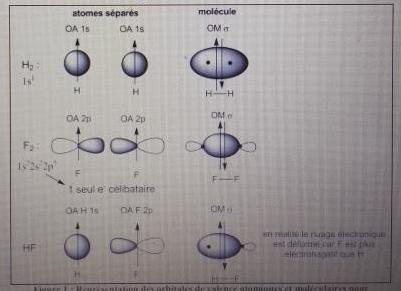
Suite du cours que je ne comprends pas :
Définition :
Une OM  est obtenue par recouvrement axial de deux OA présentant un même axe de symétrie. Les OM
est obtenue par recouvrement axial de deux OA présentant un même axe de symétrie. Les OM  est la liaison simple de Lewis.
est la liaison simple de Lewis.
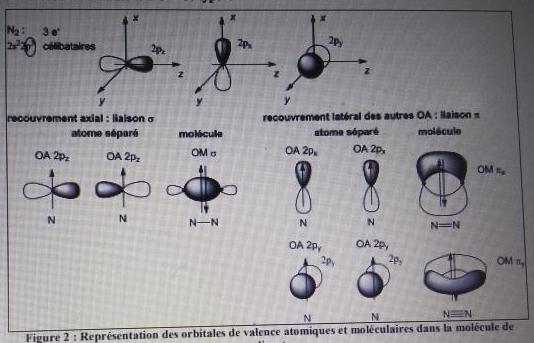
Et pour finir quelque chose du chapitre précédent que je n'avais pas non plus compris...
Merci beaucoup par avance pour toutes vos explications.
Bonsoir etudiantilois,
Il est difficile de répondre sans question précise.
En effet, au mieux, on pourrait reformuler/résumer ton cours sans pour autant clarifier ce qui te bloque :s...
Afin de répondre au mieux à ta demande, voici quelques questions 
a) Es-tu à l'aise avec les différents composant de l'atome (électrons, neutrons, protons)?
b) Vois-tu pourquoi on parle de densité de probabilité de présence d'un électrons et non pas de position figée?
c) Comprends-tu pourquoi il existe différentes forme d'OA?
d) Te souviens-tu des règle du duet et de l'octet (vues au lycée)?
e) Comprends-tu pourquoi une liaison chimique implique un recouvrement d'OA (orbitale atomique)?
f) Compte tenu des questions "c" et "e", cela te parait-il normal d'avoir différentes OM?
Bonne soirée,
Metal Oxalate
Bonsoir,
Merci beaucoup pour votre réponse.
a) Je pense que oui !
b) Pas vraiment...
c) C'est-à-dire différentes formes d'OA ?
d) Oui, ça je maîtrise bien normalement !
e) Ça, plus précisément cette notion de "recoibrement" que je croise beaucoup, je ne le comprends pas du tout...
f) Je n'ai pas compris ce qu'était une OM...
Merci beaucoup pour l'aide et bonne soirée !
@vanoise : c'est dans ce sujet que j'ai résumé mes incompréhensions, pourriez-vous m'aider svp ?
@metalOxalate : sinon vous aussi vous pouvez bien sûr m'aider, merci beaucoup !
Super, tu as donc déjà quelques bases  .
.
Comme tu le sais l'atome est fait d'un noyau constitué de neutrons et de protons (d'où une charge positive) autour duquel tournent des électrons chargé négativement. On dit que les électrons orbitent autour du noyau.
-> Une orbitale finalement, c'est un espace (un volume) dans lequel on s'attend à trouver un électron.
Remarque: Le principe d'incertitude fait qu'il est impossible de connaitre avec précision la position et la quantité de mouvement (l'énergie) d'une particule. Et les électrons sont en perpétuel mouvement.. C'est pourquoi on parle de densité de probabilité.
Un peu comme si au lieu de dire "mes clés sont probablement dans ma poche", tu disais "mes clés ont 90% de chance d'être dans ma poche, 8% d'être dans mon sac, et 2% d'être resté sur la table"  .
.
La chimie orbitalaire vise à décrire ces orbitales (leur forme, leur combinaisons, les niveaux d'énergie associés, etc.).
On a dit qu'on avait un noyau positif, et des électrons négatif qui tournent autour.
Intuitivement, on sent qu'il y a des forces visant à rapprocher les électrons des protons (les opposés s'attirent en électrostatique), mais aussi des forces visant à éloigner les électrons les uns des autres. Il apparaît alors que la position des électrons n'est pas aléatoires. D'où la définition de couches électroniques (K, L, M...) et de niveaux d'énergies.
-> Plus on est proche du noyau, plus on est bas en énergie, mais moins on peut mettre d'électrons sur la couche.
-> Plus on est loin du noyau, plus on est haut en énergie, mais plus on peut mettre d'électrons sur la couche.
Peut-être as-tu entendu parler du modèle du Boh (atome d'hydrogène avec niveaux d'énergie)?
On s'est ensuite rendu compte, que chaque couche (K, L, M...) était en fait divisé sous-couche. On alors introduit les notions de nombre quantiques (n, l, ml et nombre de spin).
- n: nombre quantique principal. Il définit le numéro de la couche (c'est ce qu'on appelait avant K, L et M).
- l: le nombre quantique azimutal. il définit le numéro de la sous-couche.
--> 0 < l < n.
NB: un couple (n, l) = une OA. Une sous couche spécifique d'une couche spécifique.
quand l =0, on parlera d'orbitale s (sigma)
quand l = 1, on parlera d'orbital p
quand l = 2, on parlera d'orbital d
quand l = 3, on parlera d'orbital f
Est-ce que jusque là ça va? 
Merci beaucoup pour toutes ces explications très claires, jusque là ça va !
Par contre, non, je n'ai pas entendu parler du modèle de l'atome de Borh. Est-ce au programme de BCPST ?
Pour la suite, c'est tout ce qui est lié à la notion de recouvrement d'OA, de création d'OM... Tout cela n'est pas clair du tout pour moi... (En particulier les 3 premières images du cours postées hier.)
Merci beaucoup par avance pour vos explications là-dessus (recouvrement, OM...).
Et j'ajoute une question liée à ce chapitre sur l'hypervalence.
Théoriquement, comment l'hypervalence s'explique-t-elle ?
J'ai compris quels atomes peuvent être hypervalents, mais malheureusement la théorie avec les orbitales qu'il y a derrière m'échappe...
Super, ça fait plaisir de voir que les explications sont compréhensibles  .
.
Pour le modèle de l'atome de Bohr, j'ignore s'il est au programme de BCPST. Mais, grossomodo, c'est un modèle expliquant la structure de l'atome d'hydrogène. Un cas simplifié du coup (1 seul proton, 1 seul électron, 1 seul neutron). C'est à partir de ce modèle qu'est apparu l'idée de niveaux d'énergie bien spécifique, et non pas de valeur aléatoire. Bref, ce qui a permis d'en arriver aux OA pour tous les atomes  .
.
Revenons à nos moutons OA !
Donc on a dit que chaque couche (K, L, M...) est divisée sous-couche. Et qu'il existe 4 nombres quantiques (n, l, ml et nombre de spin).
- n: nombre quantique principal. Il définit le numéro de la couche (c'est ce qu'on appelait avant K, L et M).
- l: le nombre quantique azimutal. il définit le numéro de la sous-couche. ( 0  l < n).
l < n).
Un type d'orbitale atomique = un couple (n, l) On verra plus tard qu'il y a 3 orbitales "2p" (n=2, l=1).
Il reste 2 nombres quantiques à définir  !
!
- ml: le nombre quantique magnétique, c'est lui permet de distinguer les différentes orbitale présente sur la même sous-couche (et donc du même type). Pour chaque couple (n, l) il y a 2n+1 valeur de ml (ml  [-l ;+l].)
[-l ;+l].)
-- Pour n =1, on n'a que l =0, il y a donc 1 (=2*0+1) seule valeur de ml possible. ml =0. On a donc une orbitale (1s)
-- Pour n =2, si l =0, il y a donc 1 (=2*0+1) seule valeur de ml possible. ml =0. On a donc une orbitale (2s)
-- Pour n =2 et l =1, on a 3 (=2*1+1) valeur de ml possibles ml = -1;0;+1.
On aura donc 3 orbitales (2p).
Une orbitale atomique = un trinôme (n, l, ml) (edit par rapport à mon post précédent)
- ms: le nombre quantique de spin. Ce qu'il faut retenir c'est qu'il ne prend que 2 valeur (+/- 0.5).
Le principe d'exclusion de Pauli nous dit qu'il ne peut pas y avoir 2 électrons avec le même quadrinome (n, l, ml, ms).
Comme (n, l, ml) correspond à une OA, et que ms peut prendre 2 valeur, on en déduit qu'une OA ne peut pas contenir plus de 2 électrons.
En pièce jointe, un tableau reprenant tout ça. Tu remarqueras alors que pour la couche K, on retrouve la règle du duet et que pour la couche L on retrouve la règle de l'octet!
Voilà pour l'essentiel sur les OA (orbitale atomiques)..
Avant de passer aux OM (orbitales moléculaires) et au recouvrement, on va parler de formes d'orbitales (dans mon prochain post)
Edit: Le modèle de Bohr est un cas simplifié du coup (1 seul proton, 1 seul électron, pas de neutron).
On a dit qu'à chaque valeur de nombre quantique azimutal "l", correspond une appellation d'orbital (s, p, d...) et qu'à chaque couple (n, l) correspond un type (1s, 2s, 2p, etc.).
=> On va maintenir voir à quoi cela correspond.
En partant de l'équation de Schrödinger, il est possible de déterminer l'équation donnant la forme d'une orbitale.
On se rend alors des choses suivantes:
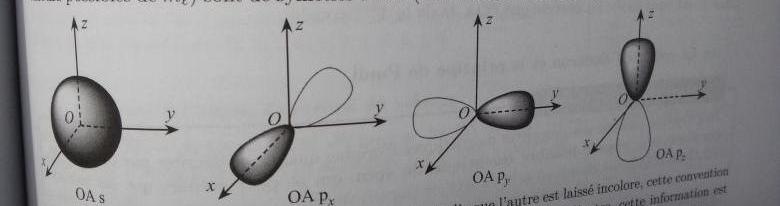
- les orbitales "s" ont une symétrie sphérique (= une sphère centrée sur le noyau).
Autrement dit, si tu t'éloigne d'une distance "r" du noyau, et que tu tournes autour du noyau, tous les points par lesquels tu passera ont autant de chance d'avoir un électron présent les uns que les autres. Comme toutes les directions de l'espace sont équivalentes en géométrie sphérique, il n'y a donc qu'une seule orbitale "s" dans chaque couche (tient, on retrouve l'idée que pour l =0, il n'y a qu'une seule valeur de ms possible et donc une seule orbitale)
- les orbitales "p" ont une symétrie axiale. Si on fixe un repère orthogonal (3 axes perpendiculaire les uns aux autres) centré sur le noyau, on aura une orbitale le long de l'axe X, une orbitale le long de l'axe Y et une orbitale le long de l'axe Z [tient, on retrouve les 3 orbitale p  ].
].
Les orbitales p sont symétriques par rapport à l'axe qui les porte, et elles sont nulles (pas d'électrons) à l'approche du centre du repère (parce qu'il y a déjà les orbitales s!)
- les orbitales "d" sont au nombre de 5, et vont couvrir des espaces non couvert par les orbitales s et p. Par exemple, les diagonales (orbitales dx-y, dx-z, dy-x).
En pièces jointes, une image montrant les différentes formes d'orbitales.
Maintenant que tu sais tout ça, on peut passer aux orbitales moléculaires  .
.
Parlons à présent des OM (orbitales moléculaires).
Dans une molécule, les atomes sont liées par des liaisons chimiques.
Comme tu le sais, ces liaisons chimiques résultent de la mise en commun d'un électron de valence (de la couche externe) par chaque atome.
Autrement dit, il y aurait un espace (volume) dans lequel la probabilité d'avoir simultanément un électron provenant de chacun des 2 atomes est non-nulle.
Conclusion: Si une OA représente l'espace dans lequel on s'attend à trouver un électron, une OM est donc l'intersection de deux OA
Réciproquement: si on rapproche 2 OA et qu'il n'y a aucune intersection (recouvrement), la probabilité d'avoir un électron de chaque atome dans le même espace est nulle. Aucune liaison chimique ne se formera.
NB: Comme il existe différents types d'OA (s, p, d, f...), leur combinaison conduit à la formation de différentes OM (sigma, pi...).
Est-ce que jusque là tout va bien?
(je n'ai pas oublié ta question sur l'hyper valence, j'en parlerai dans mon prochain post)
Bonne soirée,
Metal Oxalate
Merci beaucoup pour votre réponse, tout cela commence à devenir vraiment beaucoup plus clair !
J'ai toutefois une question, je ne comprends pas la différence entre ces 2 choses que vous avez écrites :
Un type d'orbitale atomique = un couple (n, l)
Une orbitale atomique = un trinôme (n, l, ml)
Pourriez-vous m'expliquer svp ?
Pour les OM, cela commence aussi à être plus compréhensible, merci beaucoup pour toutes ces explications !
Prenons un exemple: n =2 et l=1
Avec n=2 on sait que l'on se trouve sur la 2ème couche
Avec l =1, on sait qu'on s'intéresse aux orbitales p.
--> le couple (n, l) nous permet donc de dire que l'on s'intéresse aux orbitale "2p".
Mais on a vu que pour l =1, il y a 3 valeurs de ms possible (ms = -1; 0 ; +1). Ce qui nous a conduit à définir 3 orbitales 2p différentes (2px, 2py et 2pz).
On a donc plusieurs OA correspondant au même couple (n,l), mais une seule OA par trinome (n, l, ml).
- un monomome (n) = une couche
- un couple (n,l) = un type d'orbitale
- un trinome (n, l, ml) = une OA
- un quadrinome (n, l, ml, ms) = un électron dans une OA
Bonne journée,
Metal Oxalate
C'est parfait, merci beaucoup !!
Et à propos des OM, y a-t-il plus de choses à comprendre que ce que vous avez écrit hier ?
J'ai entendu parlé de recouvrement axial, latéral, d'axe de symétrie, d'OA p qui doivent être perpendiculaires au plan des liaisons sigma...
Pourriez-vous clarifier cela svp ?
Merci encore !