Inscription / Connexion Nouveau Sujet
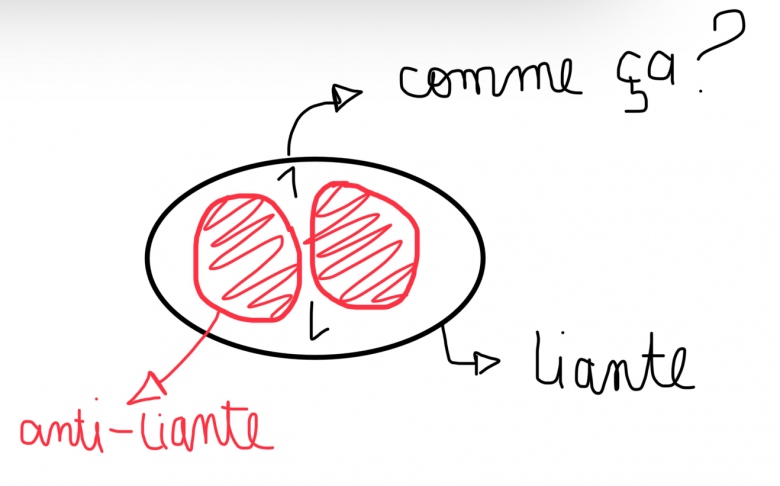
Orbital liante et antiliante
Bonjour
Je vous contacte car je ne comprend pas quelque chose : les orbitales liantes et antiliantes dans une seule et meme molecule en meme temps.
Donc dans un premier temps je vous explique ce que j?ai compris :
Les orbitales atomique (OA) ont un caractere ondulatoire (elles se comporte comme des ondes « car elles sont les fonctions d?onde d?un seul electron ») - Les OA peuvent donc faire des interferences constructives et destructives
-Les interferences sont constructives lorsque les OA sont en phase et donc de meme signe = orbitale moleculaire liante
-Les interferences sont destructives si les OA ne sont pas en phase et donc de signe opposé = orbitales moleculaire antiliante
Prenons donc l?exemple de H2 - H = 1s1 il a donc une seul orbital atomique 1s pour chacun des deux atomes lorsqu?il se rencontre cette orbitale est donc soit de meme signe pour les deux (++ ou - -)= orbitales moleculaire liante ou alors de signe opposé (+- ou -+) = orbitale moleculaire antiliante je sais qu?il doit se former autant d?orbitales moleculaire que les OA qui ont été «remplacé » mais je ne comprent la representation graphique qui en decoule (ou sont les electrons si l?antiliante et dans la liante?? Et pourquoi y?a une antiliante et une liante en meme temps si les deux orbitales doivent avoir un signe respectif et donc c?est soit liant (meme signe) soit anti liante (signe opposé), pourquoi y?a les deux?
Voila merci pour votre reponse 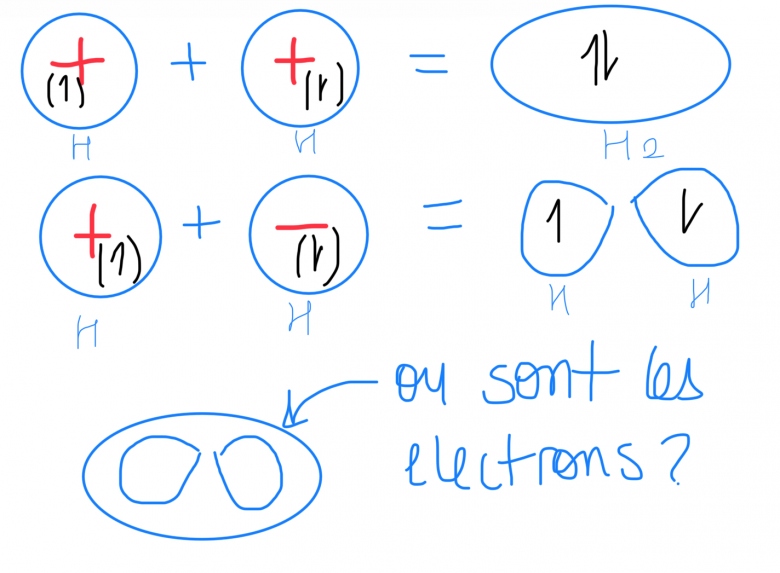
Bonjour,
Une présentation claire : ![]()
Il est plus clair, à mon avis, d'interpréter les deux orbitales comme la somme ψ+=ψ1+ψ2, liante, et la différence ψ-=ψ1-ψ2, antiliante.
On représente ψ+ et ψ-.
Lorsque le dihydrogène est dans un état stable, les deux électrons sont dans ψ+.
Le seul cas compliqué est un électron dans ψ+ et un dans ψ-, mais comme c'est un état instable.
Le fait d'avoir une liante et une antiliante est juste un changement de "coordonnées", au lieu de décomposer la fonction d'onde de l'électron sur la base (ψ1,ψ2) on la décompose sur la base (ψ+,ψ), plus simple à voir avec l'interprétation en terme de combinaison linéaire.
Le fait que l'antiliante "soit dans" la liante n'a aucun effet (tout au moins à ce niveau d'approximation : le calcul précédent ne s'applique rigoureusement qu'à H2+)
Bonjour,
Il est plus clair, à mon avis, d'interpréter les deux orbitales comme la somme ψ+=ψ1+ψ2, liante, et la différence ψ-=ψ1-ψ2, antiliante.
On représente ψ+ et ψ-.
J'ai un peu compris ce que vous voulez dire ; en phase = addition donc liantes, pas en phase = soustraction donc antiliante
Ça j'ai pas trop compris : H2 c'est la liaison de deux atomes hydrogene (il sont normalement stable c'est une liaison covalente)
Lorsque le dihydrogène est dans un état stable, les deux électrons sont dans ψ+.
Le seul cas compliqué est un électron dans ψ+ et un dans ψ-, mais comme c'est un état instable.
Ça j'ai pas du tout compris : decompposition sur une base etc et ça ne m'aide pas a me representer l'OM
Le fait d'avoir une liante et une antiliante est juste un changement de "coordonnées", au lieu de décomposer la fonction d'onde de l'électron sur la base (ψ1,ψ2) on la décompose sur la base (ψ+,ψ), plus simple à voir avec l'interprétation en terme de combinaison linéaire.
Le fait que l'antiliante "soit dans" la liante n'a aucun effet (tout au moins à ce niveau d'approximation : le calcul précédent ne s'applique rigoureusement qu'à H2+)
Ma question est : pourquoi y'a une liante et une antiliante en meme temps si les orbitales ne epuvent etre que soit en phase soit dephasé (surtout pour 1s)
Merci
ils sont normalement stables c'est une liaison covalente
SI vous avez une molécule de H2 stable, elle est dans son état d'énergie le plus bas, et donc les deux électrons sont dans ψ+.
pourquoi y'a une liante et une antiliante en meme temps si les orbitales ne peuvent être que soit en phase soit dephasé (surtout pour 1s)
Reprenez l'atome d'hydrogène, vous avez des orbitales 1s, 2s, 2p ...
Vous ne vous posez pas la question pourquoi y-a-t-il 1s et 2p en même temps ?
ψ+ et ψ- sont simplement le deux premiers niveaux des orbitales de H2 comme 1s et 2s sont les deux premiers niveaux pour H. Elles ne sont pas "en même temps", ce sont les niveaux accessibles pour les électrons.
La méthode que vous étudiez est approchée, on cherche ψ pour une molécule, si l'on est proche de l'atome n°1, la solution ne doit pas être très différente de ψ1 (1s de l'atome H n°1) et idem pour le n°2. L'idée de base est que ψ est une combinaison linéaire de ψ1 et ψ2 donc deux fonctions, et on ne "rajoute" rien, on doit donc pouvoir retrouver les deux états ψ1, ψ2 à partir de la nouvelle fonction ψ. Comme il y a deux états possibles, il faut bien deux fonctions ψ. C'est en cela que c'est une base, comme un vecteur que l'on peut représenter selon les directions xy, ou selon les directions x'y' à 45°.
Si l'électron est dans l'état ψ+, la probabilité de présence est maxi entre les deux noyaux, pour ψ-, elle est maxi autour des noyaux.
Dans votre dessin, dans quel état sont les électrons ?
Mes electrons sont donc entre les deux noyau et donc psi +
(Psi + = liante et psi - = non liantes)
Ce que j'ai compris:
Si j'ai bien compris votre messages - vous dites que les OM liantes et antiliantes existent independamment du fait qu'il y ai des electrons dedans - donc les deux electrons de H2 existent dans l'OM liante (mais l'OM non liante existe aussi elle juste vide) et ce n'est pas grave si l'OM antiliante est dans l'OM liante car en realité lorsque les electrons sont entre les noyaux ils ont dans l'OM liantes et lorsqu'il sont dans l'OM antiliante ils sont pres des deux noyaux respectif
Mais il y a encore quelque chose que je n'arrive pas a comprendre (desolé si je me repete mais je veux vraiment comprendre pour reussir a avancé dans les autres chapitre) : pourriez vous m'expliquer en utilisant les terme en phase et dephasé svp
Si les OA 1s sont en phase les electrons iront dans l'OM liante (meme si l'OM antiliante existe aussi)
Si le recouvrement est dephasé les electrons vont dans l'OM antiliante et il n'y a pas de liaison (ça je suis pas sur)
Merci pour votre aide et vos reponse
Je pense que vous avez compris.
Pour ce qui est des phases, j'ai un peu de mal à voir une phase dans une expression de type . (Il existe bien une phase pour les fonctions d'onde, mais à mon avis, cela nous entraine "ailleurs").
On fait la somme de deux fonctions et
O1 et O2 étant la position des deux noyaux et M le point courant, et comme déjà dit, dans le cas de H2, les deux combinaisons sont somme et différence.
Donc dans votre texte, en phase signifie on fait la somme, en opposition de phase, on fait la différence. Encore une fois, on fabrique une solution à partir de solutions connues.
Bonsoir,
@Brriarr : as-tu pris connaissance de mon message ici ![]() Recherche motivation et methode pour preparer un concours ?
Recherche motivation et methode pour preparer un concours ?
Rebonsoir,
@gbm, j'ai changé mon niveau d'etude
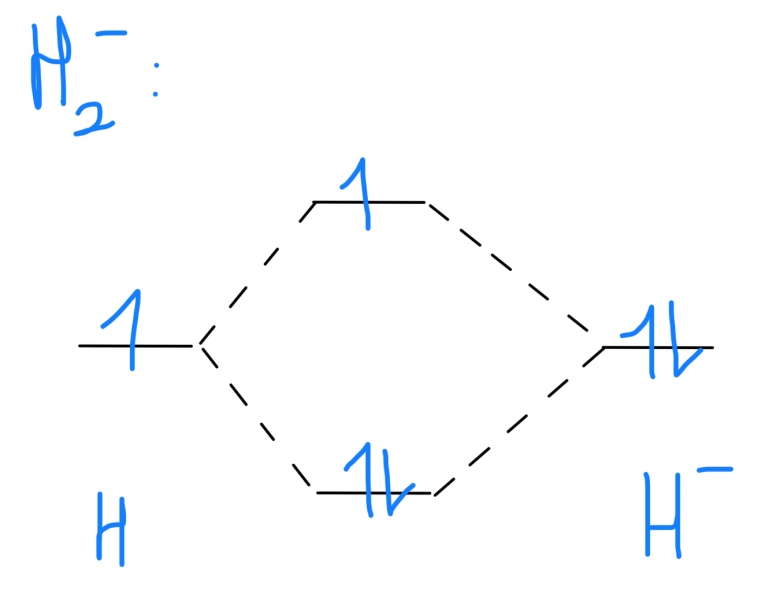
Sinon je reviens juste pour une autre question pour H2- : le diagramme d'energie est le suivant : img
Il a 2 electrons dans l'OM liante et 1 dans l'OM non liante qu'est-ce que ca veut dire ? Ça veut dire que la liaisons est fragilisé ou moins stable?