Inscription / Connexion Nouveau Sujet
Notion d'équilibre (exo partiel)
Bonjour, j'ai récupérer les exercices de chimie de partiel celui-ci porte sur les notions d'équilibres. J'ai retravailler dessus, et j'aimerais que vous disiez si j'ai bien raisonner (ce que je met n'est pas forcément ce que j'ai mis dans m'a copie...) Merci de votre aide ^^ et bonne année (en retard)
Enoncé :
Le trioxyde de soufre se décompose comme suit :
2S03(g) = 2S02(g) + 02(g)
Supposons que dans un récipient de volume V=1L les quantités de matières initiales en trioxyde de soufre, en dioxyde de souffre et en dioxygène soient respectivement de 0,176 mol; 0,625 mol et 0,436 mol.
1. Sachant que la concentration de O2 à l'équilibre vaut 0,387 mol.L-1 à 298k;
a) Calculer l'avancement à l'équilibre.
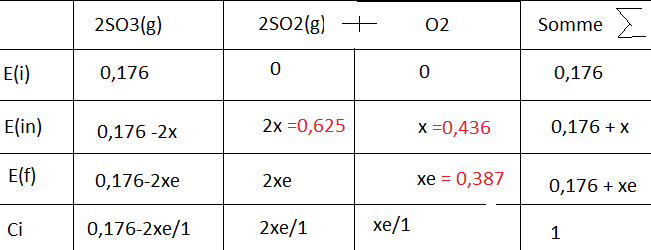
J'ai fais un tableau d'avancement pour raisonner :
Ensuite je me suis dis que au départ on avait 0,436 mol de O2 et cas l'équilibre on avait plus que 0,387 mol de O2.
J'ai donc soustrait et trouvé xe = -0,049
Je trouvais ça bizarre d'obtenir un avancement négatif j'ai donc chercher à savoir si c'était possible. et trouver cela comme réponse :"En effet, si on écrit l'équation en sens inverse, l'avancement sera alors forcément négatif."
b) Calculer les concentrations à l'équilibre en trioxyde de soufre et en dioxyde de soufre.
En reprenant mon tableau il suffisait de remplacer par "xe" :
[SO3] = 0,176 - 2 x (-0,049) = 0,274 mol/L
[S02] = 2x(-0,049) = -0,098 + 0,625 = 0,527 mol/L
La réaction est limité puisqu'il reste du produit et des réactifs, de plus la double flèche est là pour l'indiqué.
c) En déduire la constante d'équilibre Kc.
Kc=[SO2][O2] = (0,527)²(0,387)=1,07x10-1 (sans unité)
2. Etablir la relation qui existe entre Kc et Kp et calculer la valeur de Kp.
Je sais que Kp=Kc(RT)(c+d)-(a+b) (formule générale)
Kp = 1,07x10-1(8,314x298)2-2
Kp=1,07x10-1
Ton calcul des nombres de mol à l'équilibre me paraissent exacts. Je ne comprends pas le tableau d'avancement que tu présentes . les nombres de mol de départ sont indiqués ... donc pars de là !
L'expression de Kc est fausse ( donc celle de Kp aussi ) Kc = (SO2)^2*(O2)/(SO3)¨2
Le passage de Kc à Kp n'est pas évicent car PV = nRT donc P= n/V *RT = cRT mais avec P en pa , c en mol/m3 ... or tu as des concentrations en mol/L et dans Kp les pressions sont en b ( ou atm.) . Donc attention aux unités
Pour le tableau je suis repartis du nombre de mol :
0,436 - 0,387 = 0,049 (=xe) mol/L
0,625 - 0,098(=2xe) = 0,527 mol/L
0,176-2x0,049 = 0,078 mol/L
Mais je retrouve pas pareil pour SO3 :/ sa m'intrigue beaucoup
Pour Kp=Kc(RT)
J'ai pris R=0,083 L.bar.K-1.mol-1 du coup pour avoir les bonnes unités.
Du coup pour Kp j'ai trouvé 4,48
Kc=1,81x10-4
Kp=Kc(RT)(c+d)-(a+b)
Kp=1,81x10-4(0,083x298)2+1-2
Kp=4,48
* R=0,083 L.Bar.K-1.mol-1
Parcontre sa me chiffogne mais pourquoi faisons nou 0,176+2x0,049, oui on retrouve notre résultat mais dans un tableau d'avancement je n'ai jamais fais un truc de ce genre. J'espère que vous me comprenez.
lorsqu'on a un réaction équilibrée c'est que les réactions directes et inverses sont possibles simultanément. Tu vois qu'entre le départ et l'équilibre le nombre de mol de O2 a diminué , c'est donc que la réaction a eu lieu dans le sens droite -> gauche. Donc là tu as deux possibilités qui reviennent à la même chose
1) considérer que l'on fait de droite à gauche avec un avancement de 0.049 mol
2) considérer que l'on fait de gauche à droite avec un avancement de - 0.049 mol
Dans tous les cas la constante d'équilibre ( ecrite avec 2SO3 = 2SO2 + O2) est verifiée à l'équilibre


