Inscription / Connexion Nouveau Sujet
nickelage chimique
J'ai un exercice sur le nickelage chimique à l'hypophosphite
je sais que la réaction s'écrit à pH=4,5
H2PO2- + Ni2+ + H2O →H2PO3- + Ni + 2 H+
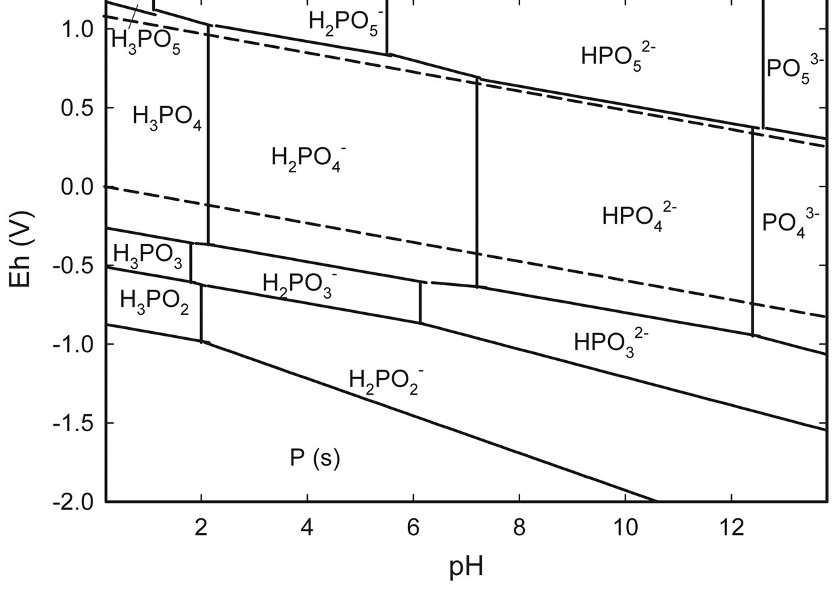
Mais en réalité comme Ni2+ /Ni a un potentiel standard de -0,25 V(d'après l'énoncé)
H2PO3- / H2PO2- un potentiel d'environ -0,72 V à pH=4,5 ( d'après le diagramme E pH) et H2PO4- / H2PO3- un potentiel d'environ -0,55 V (toujours d'après le diagramme )
Je me demande pourquoi ma réaction ce n'est pas 2H2PO2- + 3Ni2+ + 4H2O →H2PO4- + 3Ni + 8 H+
Pourquoi j'ai pas de phosphore V qui se forme ?
Merci d'avance
Bonjour
Il faudrait connaître la concentration en ions nickel(II) pour tracer avec précision dans ton diagramme de Pourbaix la frontière Ni2+/Ni mais a priori, vue la valeur du potentiel standard de ce couple les domaines de prédominance de Ni2+ et de H2PO2- sont disjoints ; il y a donc réaction quasi totale entre Ni2+ et H2PO2- mais pour cela, je crois que nous sommes d'accord. Ta question est plutôt : pourquoi obtient-on en produit H2PO3- plutôt que H2PO4-.
Du strict point de vue de la thermodynamique, il faudrait que la frontière Ni2+/Ni soit d'ordonnée comprise entre -0,55V et -0,72V. Elle est sûrement inférieure à -0,25V mais certainement un peu supérieure à -0,55V. Dans ces conditions, Il faut sans doute évoquer ici la cinétique : l'écart d'ordonnées entre les frontières Ni2+/Ni et H2PO4-/H2PO3- est trop faible : il y a blocage cinétique...
D'accord, merci beaucoup de la réponse précise
y'a t-il une règle sur le minimum de différence entre les potentiels pour espérer avoir la réaction ?


