Inscription / Connexion Nouveau Sujet
moment dipolaire méthanal
Bonsoir, j'aurai simplement besoin de votre aide pour une question d'un exercice de chimie dans lequel je trouve une incohérence.
Il faut calculer le moment dipolaire du méthanal H2CO sachant que les moments dipolaires relatifs aux liaisons C=O et C-H sont respectivement 2,3 D et 0,4 D dans cette molécule.
On considérera la géométrie de la molécule idéale.
En déduire la contribution de la polarité des liaisons C-H au moment dipolaire total.
Mon raisonnement :
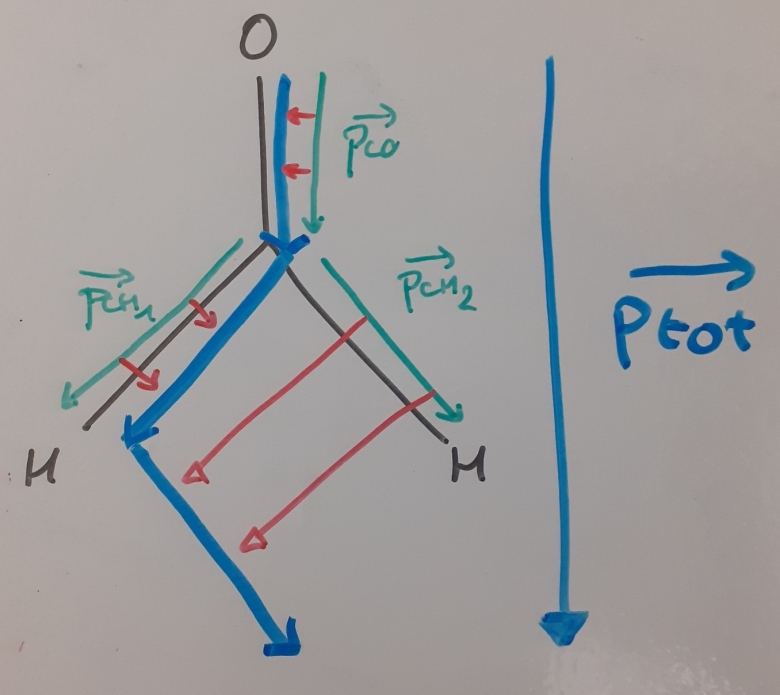
Après avoir représentée ma molécule, je déduis la valeur idéale des angles entre liaisons de 120° (donc un triangle équilatéral avec comme sommets l'oxygène et les 2 hydrogènes).
Je sais aussi que je dois trouver le moment dipolaire total des 2 liaisons C-H :
avec un produit scalaire simple, j'obtient 0,4 D donc une molécule avec un moment dipolaire total de 2,7 D.
Et cela me semble très incohérent avec le fait d'une part, que le moment dipolaire total des 2 liaisons C-H valle le moment dipolaire d'une seule liaison; et d'autre part, que ce moment dipolaire correspondant à ces 2 liaisons C-H soit tant important (on sait que en général le moment dipolaire une liaison C-H est très peu représentatif dans le moment dipolaire total d'une molécule).
Si quelqu'un pourrait me dire si mon raisonnement est bon ou si je suis totalement à côté de la plaque...
Merci d'avance et bonne soirée ! 
Bonsoir :
tu es amené à faire une somme de trois vecteurs. Compte tenu des symétries, tu peux projeter les trois vecteurs sur un axe colinéaire à l'axe de la liaison C=O. Tu peux faire un schéma et le poster ici éventuellement.
En gros oui mais les échelles ne sont pas du tout respectées. Il serait plus intéressant de calculer d'abord la somme des deux moments dipolaires des liaisons C-H. Le vecteur somme va alors être colinéaire au moment dipolaire de la liaison C=O. La méthode des projections que je t'ai indiquée dans mon premier message est rapide.
Oui oui bien entendu, j'imagine qu'il me suffit de faire une relation de Chasles entre les 2 vecteurs pC-H : puis j'obtient un vecteur somme de norme = 0.28
C'est bon ?
Essaie de faire quelque chose de vigoureux. Je t'ai indiqué une méthode possible. Compte tenu des ordres de grandeurs, le vecteur somme est colinéaire au vecteur moment dipolaire de C=O et sa norme est un peu supérieure à la norme du vecteur moment dipolaire de la liaison C=O.
Excusez-moi mais je ne comprend pas votre méthode... Qu'entendez-vous par :
projeter les trois vecteurs sur un axe colinéaire à l'axe de la liaison C=O
Tu as sûrement étudié un peu de mécanique dans tes études. Projeter une relation vectorielle sur 2 axes : tu devrais savoir faire.
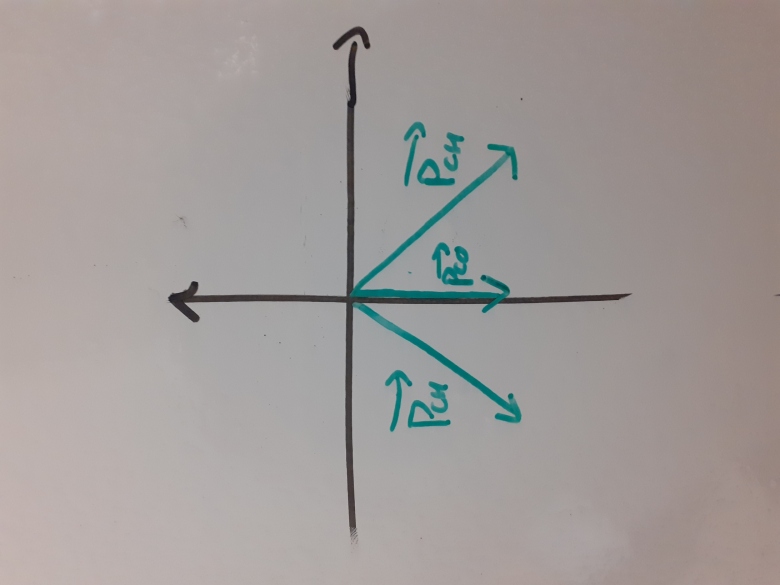
Ok pour le principe même si les échelles ne sont pas respectées. Intérêt d'orienter l'axe horizontal vers la gauche ?
Désolé mais je n'ai pas réussi à mettre l'image droite. L'axe horizontal sur l'image pointe en réalité vers le haut et idem pour l'axe vertical de l'image qui pointe réellement vers la droite.
Comment fais je maintenant ?
Le moment dipolaire que tu cherches à déterminer s'écrit :
En projetant sur les deux axes :
La méthode est utilisée dès l'enseignement secondaire avec les vecteurs forces...
Bonjour, j'espère que vous allez bien.
Reprenons si cela ne vous dérange pas.
Je n'ai plus ces souvenirs de collège/lycée...
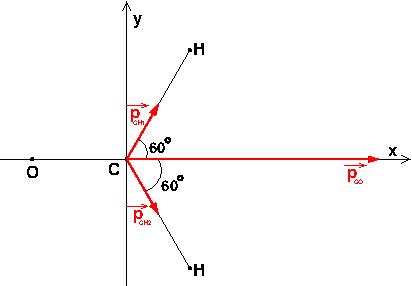
Avec ce que vous m'avez dit et un peu de trigo, je trouve :
px = 2,8
py = 0,69
Me suffit-il de faire pour avoir le moment dipolaire total ou est-ce plus complexe ? Cela me semble incohérent mais c'est la seule formule qui me vient à l'esprit pour ça...
Ah non c'est bon je pense avoir trouvé ! La somme de norme de vecteurs s'écrit :
Est-ce plutôt cela ?
Je n'ai plus ces souvenirs de collège/lycée...
Ton dernier message est tout de même correct ! Je reprends mes projections.
Le vecteur moment dipolaire de la molécule est colinéaire à l'axe de la liaison C=O puisque py est nul. La norme de ce vecteur est :
Et oui : puisque cos(60°)=0,5 : la projection sur l'axe des « x » des deux moments dipolaires C-H est égale à un moment dipolaire en norme. Ce sont les lois de l'addition vectorielle ! 2,7D alors que celui de C=O compte pour 2,3D à lui tout seul : c'est bien le moment dipolaire de la liaison C=O qui est prépondérant.