Inscription / Connexion Nouveau Sujet
Molécule plane
Bonjour,
Je cherche à déterminer si ma molécule est plane.
Je pense qu'un électron célibataire de modifie pas la géométrie de la molécule. Comme il y a un C- alors la géométrie de la molécule est tétraédrique
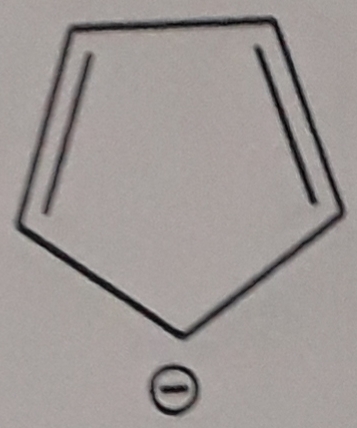
Bonsoir
Tu parles d'une molécule mais la formule fait apparaître une charge négative... Il s'agit peut-être de l'ion négatif C5H5-[/sup].
Si oui : pose-toi la question de savoir si les conditions sont réunies pour obtenir la délocalisation possible d'électrons pour obtenir un composé cyclique plan.
La notion d'hybridation sp[sup]3 : cela te parle ?
Oui, je connais la notion d'hybridation sp3: il s'agit d'une combinaison d'une orbitale s et de 3 orbitales p. 4 orbitales sp3 forment un tétraèdre.
En faisant de la mésomérie j'obtiens ça.
Je pense qu'il s'agit de l'ion C5H6- (le C- a deux liaisons avec des carbones et deux liaisons avec des hydrogènes).
Je suspecte alors que l'ion n'est pas plan.
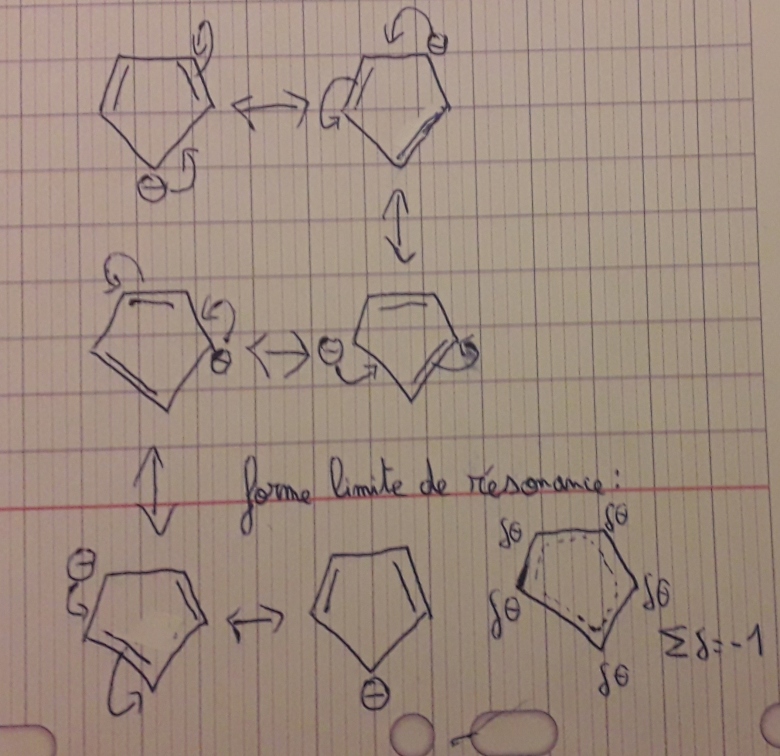
Je pense que ton raisonnement est correct. On peut passer par la notion d'hybridation .
On a ici une hybridation sp2. Chacune de ces 3 orbitales est occupée par un électron. Cela permet l'établissement par chaque C de 3 liaisons covalentes  : 2 avec les deux C voisins et 1 avec H. Restent 6 électrons occupants les 5 orbitales pz des 5 C. La règle de Huckel est satisfaite. Il s'agit d'une structure plane stabilisée par la délocalisation des 6 électrons sur le cycle.
: 2 avec les deux C voisins et 1 avec H. Restent 6 électrons occupants les 5 orbitales pz des 5 C. La règle de Huckel est satisfaite. Il s'agit d'une structure plane stabilisée par la délocalisation des 6 électrons sur le cycle.
Non, en fait j'ai un doute. Je ne sais pas comment savoir que le carbone est sp2 sans utiliser la règle du cours [un atome (hors hydrogène) lié à un carbone sp2 (qui a une double liaison) est sp2 aussi].
Je me suis trompé, en utilisant VSEPR, n(4 liaisons)+m(1 doublet non-liant)=5
Je pense que le C- n'a que 3 liaisons mais je ne sais pas pourquoi.
Lorsque l'on parle des sp2 en utilisant des cases quantiques, on parle bien des 2s2 et 2p2 qui se combine en 3sp2 et un p1 ? Et dans ces quatres cases quantique io y a un électron ?
Ah oui, je vois pourquoi il fait 3 liaisons.
Mes incompréhensions sont:
Comment combiner les cases quantiques/savoir sp3 sp2
Et pourquoi en utilisant VSEPR je trouve une géométrie tétraédrique alors que lorsque le carbone est sp2 la molécule ou l'ion est plan.
Si tu ne tiens pas compte de la délocalisation, le carbone C- serait lié par trois liaisons covalentes et possèderait un doublet de valence non liant (hybridation de type sp3). La théorie VSEPR conduirait effectivement à une structure de type tétraèdre déformé : la molécule ne serait pas plane.
En fait il faut imaginer une hybridation sp2 pour expliquer les liaisons covalentes de type  . Restent alors 6 électrons occupant l'orbitale pz (1électron par carbone sauf pour C- qui en compte deux.
. Restent alors 6 électrons occupant l'orbitale pz (1électron par carbone sauf pour C- qui en compte deux.
Règle de Hückel : 6 est de la forme 4n+2 (avec n=1) comme dans le benzène. On obtient alors un composé aromatique avec délocalisation des 6 électrons pz sur le cycle.
Pourquoi retenir cette hypothèse ? Tout simplement parce qu'elle conduit à la structure la plus stable possible : la délocalisation stabilise la structure. Les ressources sur les composés aromatiques et la règle de Hückel abondent sur le net, ici par exemple :
![]()


