Inscription / Connexion Nouveau Sujet
Mesure d'enthalpie et pertes thermiques
Bonsoir,
Je dois préparer un tp de physique. J'ai déjà fait la partie 1 mais j'ai des difficultés à faire la 2e qui s'intitule : Mesure de l'enthalpie massique de fusion de la glace avec prise en compte des pertes thermiques.
En général, j'ai des difficultés avec les exos où on ne néglige pas les pertes thermiques parce-que je ne sais jamais comment m'y prendre 
Enoncé:
Placer une masse connue ml d'eau liquide dans le calorimètre. Lancer l'acquisition de la mesure de la température.
Introduire quelques glaçons pris dans un mélange eau-glace. Bien essuyer les glaçons avant de les introduire dans le calorimètre.
Agiter soigneusement et constamment.
Arrêter les mesures plusieurs minutes après la remontée en température, lorsque vous disposez de suffisamment de valeurs pour exploiter cette zone de remontée. Peser ensuite toute l'eau du calorimètre, en déduire ms la masse de glace introduite.
J'imagine que ms = mmesurée - ml
Tout d'abord, je ne comprends pas ce qui est appelé la "remontée en température", c'est-à-dire que la température va descendre (logique à cause des glaçons) puis remonter ??? Si oui, comment ça se fait ?
Questions :
1. A quelle température sont les glaçons initialement ? Pourquoi ? Est-ce réellement précis ? Pourquoi essuyer les glaçons ?
2. Présenter la courbe T(t). Commenter et expliquer les variations observées.
3. Le calorimètre peut-il être considéré comme parfaitement calorifugé ? Justifier. Calculer à l'aide du graphique la puissance des Ppertes à travers les parois du calorimètre.
4. Calculer à partir des résultats expérimentaux et à l'aide d'un bilan enthalpique l'enthalpie massique de fusion de la glace à 0°C.
5. Par rapport à la valeur tabulée, handbook ou internet) proposer les souces d'erreurs pouvant expliquer l'écart significatif avec la valeur obtenue après avoir calculé l'erreur relative.
Voici ce que j'ai fait :
1. Les glaçons devraient être à une température inférieur ou égale à 0°C (mais après je ne vois pas comment on peut savoir la température exacte à moins qu'on nous ne l'indique).
Ce n'est pas réellement précis car les glaçons sont mélangés avec de l'eau qui augmente leur température car l'eau liquide est à une température supérieur ou égale à O°C.
Essuyer les glaçons permet d'enlever l'eau qui engendre cette imprécision de la valeur de la température des glaçons.
2. J'imagine que sur la courbe on devrait voir une diminution de température puis une stabilisation car les glaçons ajoutés refroidissent le mélange jusqu'à ce qu'on est atteint l'équilibre thermique.
3. Le calorimètre n'est pas parfaitement calorifugé car il existe toujours des pertes thermiques.
Je n'ai aucune idée de comment calculer avec le graphique Ppertes......
4. Je pense qu'il faut utiliser le graphique mais encore une fois je n'ai aucune idée pour savoir comment le faire....
5. =333,5 kJ
erreur relative = (valeur mesurée - valeur réelle) / (valeur réelle)
Les sources d'erreur peuvent être liées au fait qu'on est pas assez essuyé les glaçons, qu'on est pas assez brassé, qu'on est pas obtenue assez de points pour tracer une courbe précise.
Bonsoir
Juste quelques indications. Tu vas y réfléchir puis poser d'autres questions si nécessaire...
1° l'énoncé évoque la présence de liquide à la surface des glaçons. Il est probable dans ces conditions que l'équilibre solide liquide soit atteint donc que la température soit égale à 0°C
2° OK
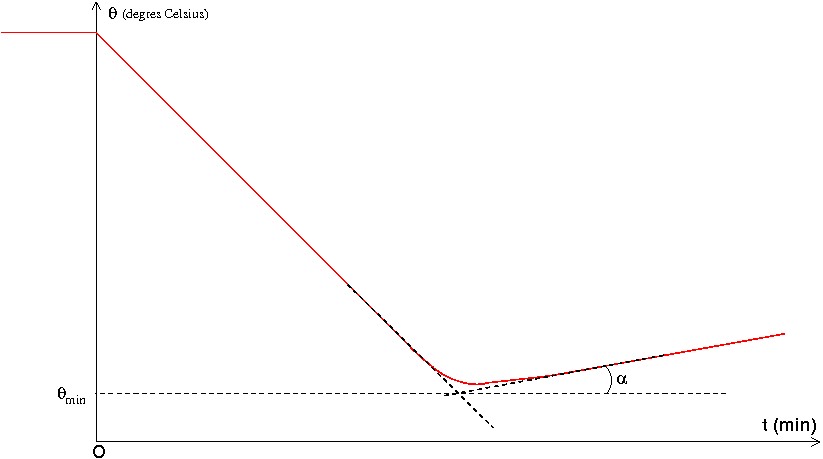
3° la température théorique d'équilibre est sans doute inférieure à la température ambiante (celle du labo). Dans ces conditions, tu vas obtenir d'abord une baisse de température de plus en plus lente puis un faible remontée de température : l'ensemble (liquide froid + calorimètre) reçoit de la chaleur fournie par l'air ambiant.
En linéarisant la partie descendante et en linéarisant la partie montante de la courbe représentant les variations de la température en fonction du temps, tu peux obtenir deux renseignements utiles :
L'intersection des deux segments va te donner la température minimale, celle à prendre en compte dans ton calcul.
Le coefficient directeur de la partie montante permet d'évaluer la puissance perdue par manque d'isolation du calorimètre.
Pour 5 : attention à l'unité.
Voici l'allure de la courbe de température que tu devrais logiquement obtenir ; t=0 est l'instant d'introduction des glaçons dans le calorimètre.
Échelle totalement arbitraire...
Merci pour ton aide 
Je pense avoir réussi : j'ai trouvé
avec
Pour la 5, je n'ai pas trop compris, je pense que tu veux que je mette l'unité en kJ/kg mais je pensais que quand on nous demandait une enthalpie massique de changement d'état on devait mettre l'unité en kJ et on le notait avec un h et que quand on nous demandait une enthalpie de changement d'état on devait mettre l'unité en kJ/kg et on le notait H
Le plus souvent en thermodynamique les grandeurs massiques sont notées en minuscules . Pour l'enthalpie, H se mesure en kJ et h en kJ/kg. A adapter au contexte.
D'accord avec ton expression de l'enthalpie massique de fusion de la glace à 0°C. Comme déjà expliqué, il est probable que tu puisses considérer T2 T0.
T0.
En première approximation, tenir compte des défauts d'isolation du calorimètre consiste à poser Tf=Tmin (voir courbe ci-dessus). Un raisonnement plus sophistiqué, pas nécessairement demandé ici car assez délicat, consiste à évaluer la puissance perdue par défaut d'isolation par la mesure du coefficient directeur de la droite obtenue après la fonte de la glace.


