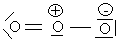Inscription / Connexion Nouveau Sujet
mésomère
salut à tous, je ne comprends pas comment avec Lewis est arrivé à ça pour O3
je ne comprends d'ou sont venu ces charge + et - puisque O3 ne porte aucune charge 
moi j'ai pensé juste que j'allais excité un seul oxygène pour qu'il ait une case vacante et laisser le deux autres comme ils sont :/ quelqu'un peut m'aider merci d'avance
Chaque O a 6 electrons externes donc dans O3 il y a 18 electrons soit 9 doublets à mettre sur les O en respectant la règle de l'octet donc on arrive au schéma que tu indiques
En réalité les O terminaux jouent le meme role et chaque liaison OO est intermediaire entre une simple et une double liaison donc on doit représenter la molécule d'ozone comme etant une forme hybride entre 2 formules mésomères: celle que tu as mis et l'autre où O de droite est relié par la double liaison et O de gauche porte les 3 doublets non liants.
Pour les charges indiquées : on compare chaque oxygène dans cette molécule à un O libre qui a 6 electrons externes en attribuant 2 electrons par doublet non partagé ( non liant) et 1e- par doublet de liaison .
- pour O à gauche : 2 doublets non liants + 2 e ( 1 de chaque liaison ) = 6 e : pas de charge
- pour O milieu : doublet non liant + 3*1e- ( 3 liaisons ) = 5e- donc 1 charge +
- pour O de droite : 3 doublets non laiants + 1e- de la liaison = 7e donc 1 charge -
l'ensemble de la molécule est neutre .
notes : VSEPR nous indique que cette molécule est coudée avec un angle d'environ 120°