Inscription / Connexion Nouveau Sujet
Loi de Joule et liquides
Bonjour,
J'ai une question de cours à vous poser.
J'ai pu voir ici notamment ![]() que la loi de Joule s'utilisait pour les gaz parfaits, ou les gaz que l'on assimile à des gaz parfaits (typiquement ceux à basse pression)
que la loi de Joule s'utilisait pour les gaz parfaits, ou les gaz que l'on assimile à des gaz parfaits (typiquement ceux à basse pression)
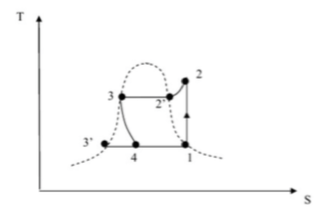
Or j'ai un exercice où l'on me demande une variation d'enthalpie entre trois états états : 3, 3' et 4, sachant que l'état 3 est sur la courbe de saturation, l'état 3' également et non le 4.
On dit également que sur le chemin 3-4 la variation est isenthalpique. (le graphe est ci-dessous)
Ainsi on peut déterminer x la fraction vapeur en comparant les deux transformations selon deux différents parcours (33'4 et 34) puisque H est une fonction d'état.
Or j'ai également la correction et ils utilisent sur le chemin 33'. Or c'est un liquide est non un gaz, cela n'importe pas ?
Je vous remercie par avance pour vos réponses. 
***Raccourci url ajouté***
Re,
Je me suis peut-être emporté un peu vite, ce n'est pas Cp mais cL qui est utilisé, avec cL la capacité thermique massique de l'ammoniac liquide saturant.
Mais la formule ressemble étrangement à la seconde loi de Joule.
Si vous pouviez m'éclairer j'en serai ravi.
Bonjour
Je crois qu'il y a peut-être une confusion dans ta tête : la thermo : c'est très pointilleux !
Pour un gaz parfait : les lois de Joule précisent :
Quelle que soit le type de transformation ! Si tu préfères : ces relations sont toujours valides.
Pour un système fermé quelconque: si ce système évolue de façon isobare ou de façon monobare (sous pression extérieure fixe) :
Pour un liquide ou un solide, sauf cas des pressions extrêmement élevées, on peut considérer les propriétés thermodynamques indépendantes de la pression et écrire :
La transformation 3-3' correspond au troisième cas évoqué .
Bonsoir,
Je vous remercie pour votre réponse. 
Je pense aussi que c'est une confusion dans ma tête !
Pour la première relation je suis totalement d'accord avec vous.
Pour la seconde, je le suis aussi, c'est d'ailleurs celle que l'on utilise en thermochimie en disant que le produit de l'avancement est de l'enthalpie de réaction standard est égal à Q.
Pour la troisième, est-ce valable pour tout type de système ou faut-il que le système soit fermé ? J'aurais tendance à dire que c'est valable pour tout type de système en me fiant aux relations du 1er principe que j'ai pour système ouverts et fermés.
Précision : telle que je l'ai écrite, la relation concerne dans les trois cas un système fermé.
Si le système étudié est ouvert, il est commode de se ramener à l'étude des variations d'enthalpie massique et appliquer à chaque kilogramme de matière les lois des systèmes fermés. Il suffit alors de remplacer l'enthalpie H par l'enthalpie massique h. Dans le troisième cas, on peut écrire :


