Inscription / Connexion Nouveau Sujet
Liaison Chimique - OA
Bonjour, je suis en L3 Chimie est j'ai une annale de liaison chimique qui me pose un gros soucis, je n'arrive pas à débuter ce problème. Est il possible d'avoir quelques pistes pour me guider dans ce problème?
Je vous le poste en lien
En vous remerciant d'avance.
** lien vers l'énoncé effacé **
Edit Coll : si tu veux de l'aide, merci de faire l'effort de recopier ton énoncé sur le forum 
![]()
Désolé je pensais que ce serait plus clair avec le sujet et les figures, bref :
"La guanidine, dont la structure moléculaire est donnée ci-contre, est une base très forte de pKa = 14
(cf. le pKa de NH3 est égal à 9.3). Le doublet électronique libre de l'azote N1, qui fait formellement partie de système σ (N1 est dans l'hybridation σ sp2), est responsable de cette basicité élevée. Les calculs semi-empiriques PM3 donnent l'énergie de l'orbitale moléculaire construite principalement sur la pair libre N1 égale à -9.30 eV et la charge de N1 égale à -0.22 e-. La même méthode de calculs donne pour NH3 l'énergie de sa HOMO égale -10.01 eV et la charge sur l'azote de +0.01 e-.
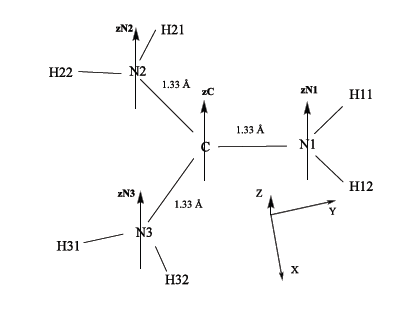
Le cation [CH6N3]+
Comme prévu, la protonation de la guanidine selon l'équilibre acido-basique classique B + H+ = BH+ a lieu
sur l'azote N1. On observe une forte stabilisation de la molécule neutre (PM3 : Etotale = -682.1 eV) en
passant au cation (Etotale=-691.4 eV). La géométrie du cation est donnée ci-dessous. La molécule cationique
est plane ; tous les atomes sont placés dans le plan XY du repère cartésien. C'est le plan du système σ des
liaisons.
(voir figure attachée)
On considère la base complète d'orbitales atomiques (OA) de valence des tous les atomes :
Les OA's 1s des 6 atomes d'hydrogène : h11 … h32 ;
Les OA's 2s et 2p de carbone : sC, xC, yC, zC ;
Les OA's 2s et 2p des trois N : sN1, sN2, sN3, xN1, xN2, xN3, yN1, yN2, yN3, zN1, zN2, zN3
Donc voici les questions:
A1. Quel est le nombre d'électrons de valence dans la molécule cationique ?
A2. Quel est le nombre total d'orbitales moléculaires (OM)?
A3. Quel est le nombre des liaisons σ et le nombre des OM σ ?
A4. Quel est le nombre d'électrons à placer dans les OM σ ?
A5. Quel est alors le nombre d'OM π et le nombre d'électrons π (électrons dans les OM π)? (donner la
réponse maintenant, ou mieux, après l'étude de point C.
Si quelqu'un pouvait m'indiquer la marche à suivre pour débuter cette annale ce serait vraiment sympa.