Inscription / Connexion Nouveau Sujet
les gaz parfait
Bonjour,
exercice :
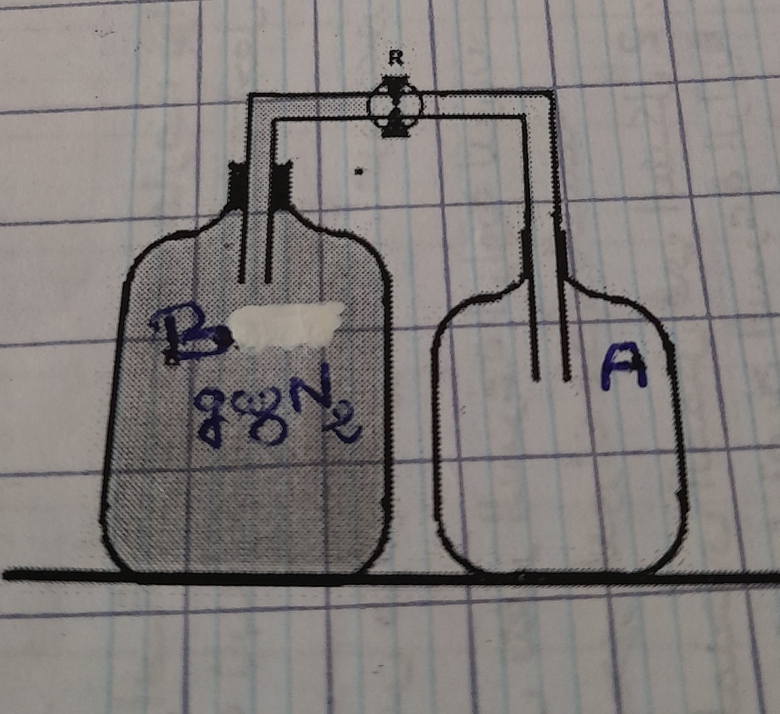
On relie deux bouteilles, A de volume 1L et B de volume 4L, par un tube de volume négligeable. (figure)
Au début de l'expérience, A était vide alors que B contenait le diazote. À 0°c et P=1,01325*10^5 Pa, on considère ce gaz comme étant parfait.
1.calculer la quantité de matière contenue dans B et en déduire sa masse.
Réponse : d'après la loi des gaz parfait, PV=n.R.T
d'où
A.N :
 0.18mol . D'où m(N2)= 0,18*28=5g
0.18mol . D'où m(N2)= 0,18*28=5g
2 Calculer le volume molaire de ce gaz dans les conditions expérimentales de température et de pression,
Réponse : .
3 .On maintient la température constante et on ouvre le robinet R.
3.1 Déterminer à l'état final la pression P dans les 2 bouteilles.
Réponse : PB ?
- on applique la loi de Boyle-Mariotte au variation subit par N2 de la bouteille B :
- PA?
Réponse : on applique la loi des gaz parfaits ici , PAVA=nRT, or
n=VA/Vm, on remplace dans l'équation d'état on aura PA= (RT/Vm)
A.N :
3.2. Déterminer la quantité de matière de diazote dans chaque bouteille.
pour A : n=1L/22.4 ; n=0.04 mol environ pour B : n = 0.18-0.04=0.14 mol.
j'ai des doutes pour cette dernière question ( les quantités de matière surtout en B ).
Merci de me corriger.
Bonjour
1 : OK
2 : bon raisonnement mais un volume molaire se mesure en L/mol, pas en litres.
3 : la loi de Mariotte (puisque T fixe) donne directement le résultat : à l'équilibre, la pression est la même dans les deux réservoir et vérifie :
Pi.VB = Pf.(VA + VB)
Cela devrait conduire à une pression finale égale au 4/5 de la pression initiale. Le récipient A contiendra alors (1/5) de la quantité initiale de gaz et le récipient B en contiendra les (4/5). En effet, la pression et la températures étant les mêmes dans chaque récipient, les quantités sont proportionnelles aux volumes.