Inscription / Connexion Nouveau Sujet
Les composés aromatiques
Bonjour tout le monde
Je suis boqué sur ce t'exo ,aidez moi svp
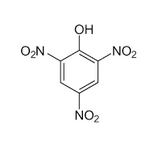
Au cours d'une expérience ,un groupe de chercheurs chauffe 1g de l'acide picrique ( le 2,4,6- trinitrophenol ) de formule:
L'acide picrique chauffé se décompose de façon explosive en : vapeur d'eau , diazote ,dioxyde de carbone et carbone.
1) Écris l'équation-bilan de la réaction de décomposition.
2) Quel est le volume de gaz dégagé ( ramené dans les CNTP : l'eau est liquide ). Conclus
Je ne sais par où commencer puisqu'en classe nous avons vu que les réactions d'addition et de substitution sur le benzene
Bonjour,
a) Recherche la formule brute de l'acide picrique.
b) Ecris l'équation-bilan de la réaction.
c) Recherche la masse molaire de l'acide picrique, puis la quantité de matière de cet acide contenue dans 1g
d) Identifie les gaz parmi les produits formés.
e) A l'aide d'un tableau d'avancement ou de toute autre méthode de ton choix, calcule les quantités de matière, puis les volumes occupés par les gaz formés
f) Réponds à la question posée.
Je demande juste de l'aide pour mon exo et je ne comprend pas PK tu as mis un autre exo qui ressemble au mien
Je n'ai pas mis un autre exercice.
J'ai seulement établi un plan en 6 étapes pour résoudre ton exercice.
Etape a)
Recherche la formule brute de l'acide picrique.
Que proposes tu ?
Oui, c'est la bonne formule.
Etape b :
Ecris l'équation-bilan de la réaction.
Le réactif est l'acide picrique C6H3N3O7
Les produits sont H2O, N2, CO2, C
Je conseille d'équilibrer les éléments chimiques dans l'ordre suivant : H, N, O, C
Que proposes tu ?
Oui,
il se décompose de manière explosive sous l'action de la chaleur en donnant les produits H2O, N2, CO2, C
J'ai fini ,c'était difficile
C6H3N3O7 => 3/2 H2O + 3/2 N2 + 11/4 CO2 +13/4 C
4 (C6H3N3O7) => 6H2O + 6 N2 + 11 CO2 + 13H2O
En tout cas, sauf une erreur de recopie pour le Carbone, ton bilan est exact :
4 C6H3N3O7 => 6H2O + 6 N2 + 11 CO2 + 13C
Tu peux passer aux étapes suivantes ....
La masse molaire M d'un composé ne dépend jamais de l'équation de la réaction.
Donc tu ne multiplies pas par 4 la valeur de M(acide picrique)
Je suis passé par le bilan molaire pour déterminer n(CO2 ) et n (N2)
n(CO2)=0.0121mol
n(N2)=6.6×10^-3
4,4.10-3 mol est un résultat intermédiaire qui va être réutilisé.
Il importe de ne pas trop l'arrondir pour éviter de propager une erreur.
m(A) = 1g
On peut continuer le calcul avec n(A) = (1/229) mol
Oui, les gaz produits sont bien CO2 et N2[sub][/sub]
Et je suis nouveau ,je ne sais pas comment faire pour voir tes reponses rapidement ( je suis obligé d'entrer dans mon profil ,voir les membres en ligne ,cliquer sur ton nom et ensuite regarder tes messages ,pour répondre du coup si y a un autre moyen de voir les messages ,montre moi stp . et Mrc pour toute ton aide
Il est indispensable de justifier les valeurs 0,0120 et et 6,6.10-3 que tu utilises.
Tu peux conclure en calculant le volume total gazeux obtenu.
Je dois me déconnecter maintenant.
Retour prévu dans la soirée.