Inscription / Connexion Nouveau Sujet
le sens des moyennes de températures
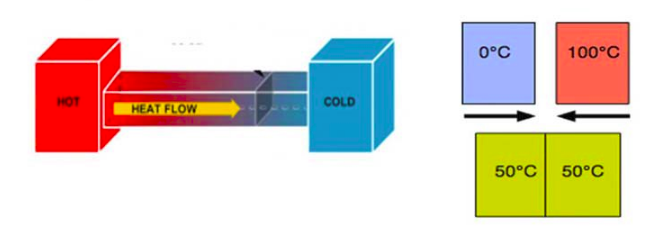
En lisant un article ce matin , je suis tombé sur le schéma suivant en pièce jointe
je connais les lois de fourrier (où l'idée vague que je m'en fait)
néanmoins sur l'image indiquée, je suis surpris que l'on obtienne la moyenne (pondérées) des températures à l'équilibre,
en passant outre le fait que le système est "idéalement" isolé,
comment expliquer ce fait ?
d'ailleurs est ce que c'est vrai ? (je crois que l'échelle en Celcius est une translation de l'échelle en Kelvin (la vraie))
si à la fin il y a un équilibre ne devrait t-il pas plutôt être une somme obtenue par une moyenne de somme d'exponentielles ? (je songe à un équilibre de Gibbs)
Il y a confusion entre 2 notions d'équilibre dans ma tête.
ps: je n'ai qu'une faible formation en physique... la formulation de ma question est naïve
soyez indulgents et pédagogues si possible.
Bonne journée.
Euh désolé , je n'avais pas lu en entier les règles du forum:
on a deux volumes identiques contenant 2 fluides identiques mais à des températures différentes séparées par une paroi,
on ouvre la paroi (je crois que c'est l'expérience de Kelvin)
en quoi cet équilibre est différent d'un équilibre de Gibbs ?
y-a-t-il un lien ?
Merci
Bonjour
Loi de Fourier : elle permet d'étudier comment évolue la température en fonction du temps. Elle n'est pas nécessaire ici dans la mesure où on cherche juste une relation entre les paramètres initiaux et les paramètres à l'état final d'équilibre.
Équilibre de Gibbs : La fonction enthalpie libre de Gibbs permet d'étudier l'évolution vers un état d'équilibre d'un système sous pression extérieure fixe échangeant de la chaleur avec un thermostat . Pas vraiment d'intérêt ici.
je crois que c'est l'expérience de Kelvin
Je reviens à ton expérience : les deux fluides sont identiques et de même masse : ils ont donc la même capacité thermique C. L'ensemble de ces deux fluides est isolé thermiquement : cela signifie que la quantité de chaleur perdue par le fluide chaud est égale à la quantité de chaleur reçue par le fluide froid.
Le fluide chaud passe de la température initiale T1 à la température d'équilibre final Tf ; il perd la quantité de chaleur :
Q1=C(T1-Tf)
Le fluide chaud passe de la température initiale T1 à la température finale Tf commune aux deux fluides à l'état final. Il reçoit la quantité de chaleur :
Q2=C(Tf-T2)
Puisque Q1=Q2 :
T1-Tf=Tf-T2
donc :
Remarque : cette égalité est aussi vérifiée si les températures sont exprimées en degrés Celsius.
Merci Vanoise, ça éclaircit pas, mal de choses dans ma tête
juste une dernière précision:
pour l'équilibre de Gibbs l'étude de l'évolution se fait à une échelle locale ? ou sur un système macroscopique ?