Inscription / Connexion Nouveau Sujet
Le protoxyde d’azote
Bonjour, j'ai un peu de mal sur un exercice de chimie que voilà;
Le protoxyde d'azote.
Le protoxyde d'azote de formule brute N2O est aussi connu sous le nom de gaz hilarant. C'est un gaz aux nombreux usages : il est utilisé dans les cartouches pour siphon à chantilly, dans certains aérosols, dans les kits NOS qui augmentent la puissance des moteurs à combustion interne, ou encore en chirurgie comme agent antalgique et anesthésique. Mais détourné de ces usages courants, il est parfois inhalé comme produit euphorisant, ce qui lui vaut une surveillance accrue par l'observatoire français des drogues et des toxicomanies. Cette pratique dangereuse et addictive, touchant souvent un public jeune et insouciant, est à proscrire absolument. Cette partie étudie la cinétique de décomposition de cette molécule.
Soit la réaction de décomposition de N2O suivante, supposée totale dans le domaine de température T considéré :
N2O(g)= N2 (g) + (1/2)O2 (2)
À l'instant initial t=0, on introduit dans un réacteur thermostaté à la température T, de volume constant V, préalablement vidé, une quantité n1 de protoxyde d'azote à la pression initiale P1.
Soit n(t) la quantité de matière en protoxyde d'azote à une date ultérieure t quelconque. On suit l'évolution de la réaction en mesurant la pression totale P(t) en fonction du temps. Les résultats obtenus à 873 K sont reportés dans le tableau ci-dessous.
| t(s) | 0 | 25 | 45 | 90 |
| P(t)/P1 | 1,000 | 1,120 | 1,196 | 1,314 |
Tableau - Valeurs du rapport P/P1 en fonction du temps
Q1. Établir l'expression de P(t)-(3/2)P1 en fonction de n(t), R, T et V.
Q2. En déduire l'expression de la vitesse volumique de la réaction
La réaction est d'ordre 1 par rapport à N2O avec k la constante de vitesse à la température T.
Q.3 Établir l'équation différentielle vérifiée par P(t). On la mettra sous la forme:
Q.4 Donner l'expression de P(t) et l'allure du graphe correspondant.
Q.5 Quelle courbe doit-on tracer pour vérifier à l'aide d'une régression linéaire l'expression de P(t)?
Représenter cette courbe à l'aide d'un script Python et effectuer, toujours avec Python, une régression linéaire pour valider la linéarité de la courbe obtenue. En déduire la valeur de k.
Écrire les scripts à la main, puis tester avec l'ordinateur.
Q.6 Rappeler la définition du temps de demi-réaction t1/2puis l'exprimer pour une réaction d'ordre 1.
Calculer t1/2 pour la réaction (2)
Q.7 Rappeler la loi d'Arrhenius. L'énergie d'activation de la réaction est Ea=280 kJ.mol-1.
Calculer le temps de demi-réaction à la température T2=1200K.
Alors voilà, cela fait quelques années que je n'ai pas fait de chimie mais bon, pour la Q.1 j'ai essayé de faire un tableau d'avancement en mol (je ne sais pas si c'est utile). Aussi, j'ai remarqué que P1=P(O)=n1RT/V
Avec mon tableau d'avancement, je vois que n(t)=n1-
Mais même avec ça, je n'arrive pas à exprimer P(t)-(3/2)P1 seulement avec n(t), R,T et V..
Bonjour
Il faut remplir un tableau d'avancement comme tu l'as fait.
Applique ensuite la loi des gaz parfait à l'état initial 1 puis à l'état quelconque de date t. Tu vas ainsi obtenir l'expression de
en fonction de RT,V, n1 et ξ.
Ensuite, comme tu l'as écrit :
n(t)=n1 - ξ...
Ok j'ai poursuivi et j'obtiens:
Donc après calcul, j'obtiens que:
Et donc pour la question 2, j'obtiens que:
Je ne sais pas si tout est juste, et si c'est le cas, je ne vois comment aborder la question 3..
Je sais établir des équations différentielles quand on a des concentrations, mais là ce n'est pas le cas..
Pour qu'une expression littérale ait de bonnes chances d'être correcte, elle doit remplir deux conditions :
1° : être homogène ; cela signifie, entre autre chose que les additions et soustractions ne doivent concerner que des grandeurs de même dimension physique. Soustraire ”1” simple nombre sans dimension physique à ”RT” qui correspond à une énergie molaire est donc nécessairement faux.
2° : être réaliste et en particulier donner les bons résultats dans les cas particuliers simples. Ton tableau d'avancement montre que, quand t passe de zéro à l'infini, n(t) passe de n1 à zéro et P(t) passe de la valeur P1 à la valeur 3P1/2. Est-ce le cas avec tes résultats ?
Un peu d'aide :
Tu peux vérifier que cette formule est homogène et que les deux cas particuliers évoqués sont en accord avec elle.
Ah oui, désolé j'ai un peu de mal. Mais j'ai bien compris et je vais essayer de faire ainsi la question 2.
Pour la question 3, on nous dit que la reaction est d'ordre 1 par rapport à N2O.
Donc la loi de vitesse s'écrit:
Et d'après la question 2;
Et donc d'après la question 1:
Et ainsi, l'équation différentielle vérifiée par P est:
Pour la question 4;
La solution est de la forme:
où A et B sont réels
On recherche alors une solution particulière B qui est une constante car le second membre dans l'equation différentielle (3/2kP1 ) est constant.
Donc
Or, B vérifie:
Ainsi:
Physiquement, B correspond à la valeur atteinte par P(t) quand t tend vers l'infini (conformément à ce que vous m'avez dit à la question 1).
Et avec la condition initiale à savoir;
Alors on a:
Donc:
Comment puis-je tracer le graphe ensuite? Car dans l'énoncé c'est P(t)/P1 en fonction de t qui est donné et non juste P(t).
J'évalue avec des valeurs avec ma nouvelle expression de P(t)?
Je pense avoir compris, le tableau nous donne le proportion de P1 dans P(t) ce qui nous permet de placer les point à:
P1>0, à t=0 s
1,120P1 à t=25 s
1,196P1 à t=45 s
1,314P1 à t=90 s
1,5P1 quand t +
+
Pour la question 5, je ne sais pas trop..
J'aurais envie de dire que comme pour la concentration à un ordre 1, il faut tracer le logarithme neprien de la concentration en fonction du temps… mais là ce sont des pressions
Tu as failli commettre une nouvelle faute d'homogénéité mais tu as aussitôt rectifié.
Ayant obtenu l'expression de P en fonction de t, facile d'obtenir l'expression en fonction de t du rapport P(t)/P1. Quelle est ainsi l'expression du logarithme neperien de ce rapport ?
J'ai en fait laissé passer une étourderie dans ton message de 21h03 :
Cela modifie ton dernier message :
On place les point expérimentaux d'abscisses t et d'ordonnées Y. Si la cinétique est bien d'ordre 1, on va obtenir un ensemble de points sensiblement alignés avec l'origine du repère. Le coefficient directeur de la droite moyenne permet d'obtenir la valeur de la constante k. Cela se fait rapidement avec un tableur type libreoffice ou excel. On peut aussi écrire un petit programme en Python mais cela demande un minimum de connaissances sur ce langage de programmation...
Bonjour vanoise, j'ai réctifié mon erreur maladroite, et j'ai écrit un script python que voilà:
from math import*
import numpy as np
import matplotlib.pyplot as plt
t=np.array([0, 25, 45, 90])
p=np.array([log(3-2), log(3-2*1.120), log(3-2*1.196), log(3-2*1.314)])
r=np.polyfit(t,p,1) #équation y=r[0]*t+r[1]
plt.plot(t, np.polyval(r,t))
plt.xlabel('temps t')
plt.ylabel('ln(3-P(t)/P1')
plt.title('Graphique- ln(3-P(t)/P1) en fonction du temps')
plt.grid()
plt.show()
print('pente',r[0])
print('ordonnée a origine', p[1])
Qu'en pensez vous?
J'ai juste une question pour la question 4, on nous demande de tracer l'allure du graphe de P en fonction de t mais nous n'avons pas la valeur de P1 et étant donné que l'expression de P(t) contient P1 on ne peut pas savoir si?
Tu te débrouilles bien avec Python. Voila ce que j'obtiens de mon côté. J'ai demandé d'afficher la valeur de k.
On te demande juste l'allure de la courbe, pas un tracé précis. Représenter une branche d'exponentielle telle que P(0)=P1 avec une asymptote horizontale en P=3P1/2 devrait suffire puisque ni la valeur de P1 ni celle de n1 ne sont indiquées.
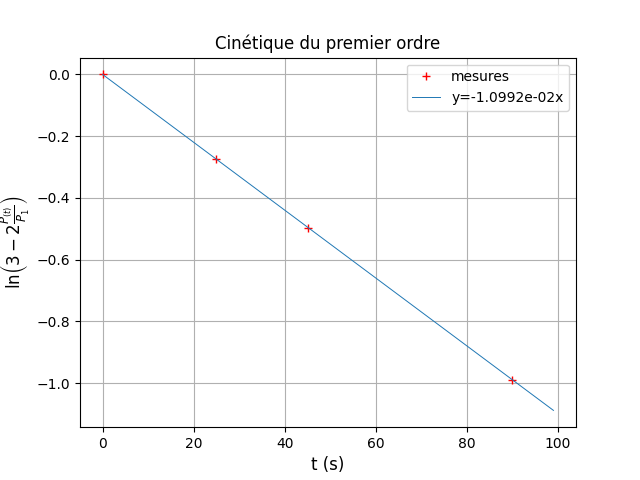
Oui j'obtiens le même type de courbe mais du coup quelque chose m'interpelle..
On ne devrait pas trouver un ordre positif? Qui en plus devrait être 1 non?
Là on obtiens un k négatif environ égale à -0,01.. ?
Pour la question 6:
Le temps de demi-reaction est le temps au bout duquel la moitié du réactif limitant a été consommé.
Ici, le temps de demi-réaction correspond au temps pour lequel:
Donc:
Donc:
Et ainsi:
Or, d'après Q.5, k -0,01
-0,01
Donc:
A.N: t1/2=69,3 s 1 min 9s
1 min 9s
Pour la question 7:
Loi d'Arrhenius:
Où A est le facteur d'Arrhenius que l'on peut ici déterminer à l'aide des informations trouvées précédemment:
Données:Ea=280kj.mol-1
Donc:
A.N: à T=873 K, k=-0,01
Donc A=-5,67*1014
À T2=1200K
A.N: k2 -367
-367
D'après Q.6;
A.N: t'1/2=2ms
Conclusion: Lorsqu'on augmente la température, la vitesse de réaction augmente (d'un facteur 104) puisque le temps de réaction diminue.
Relis mon message du 28-10-21 à 23:30. Il conduit à Y=-k.t ; puisqu'on obtient une droite de coefficient directeur négatif, la constante de vitesse est une valeur positive : k=1,10.10-2s-1
Pour une cinétique d'ordre 1 :
Pour la suite, la méthode est bonne mais attention à la cohérence sur la précision des résultats : tu ne peux pas fournir un résultat avec trois chiffres significatifs à partir d'une valeur de k arrondie à un seul chiffre significatifs. Il faut faire tous les calculs intermédiaires sans arrondis et arrondir le résultat final en fonction de la précision des données. Lorsqu'il y a manque de cohérence sur les précisions des diverses données, ce qui malheureusement arrive assez souvent, arrondir à trois chiffres significatifs est un compromis en général accepté.
D'accord donc je ne calcule pas k2, je garde l'expression littérale jusqu'à la fin, et j'exprime mon t'1/2 avec 3 chiffres significatifs?
Tu peux donner une valeur arrondie de k2 mais, pour la suite du calcul, tu utilises la valeur non arrondie de k2 présente dans la mémoire de ta calculatrice. Sinon, trop d'arrondis successifs peuvent conduire à des résultats aberrants. Regarde par exemple la valeur de t1/2 que tu avais obtenue par rapport à celle obtenue avec ma méthode...
Ah d'accord je comprends, je vais reprendre les calculs sans les arrondies et je vous dirai ce que je trouve au final vanoise. Merci beaucoup en tout cas
Pourtant vanoise quand j'écris la démonstration à 14h24 pour le t1/2 à la question 6, j'ai bien littéralement ln(2)/-k non?
Ou va le - pour vous?
Je ne vois pas où est on erreur dans ma démonstration, car je sais que on doit arriver à du ln(2)/k mais il faut le redemontrer je pense..
Reprends au besoin ton cours sur la cinétique d'ordre 1...Puisque t1/2 et k sont des valeurs positives, nécessairement :
et pas l'opposé !
D'ailleurs : le coefficient directeur de la droite moyenne est une valeur négative et il a été démontré que ce coefficient directeur est (-k). Cela conduit bien à k>0 !
Non mais ça je le sais, que t1/2 est un temps donc nécessairement positif..
Mais là dans le cas de l'exercice il faut bien redémontrer (comme dans mon cours) l'expression de t1/2 et avec l'exercice ici j'ai bien ln(2)/-k et pas ln(2)/k regardez ce que j'ai écrit à 14h24..
On est d'accord sur le fait que l'expression de P(t) est:
Et le temps de demi reaction est le temps pour lequel:
Et avec ça on aboutit bien à ln(2)/-k=t1/2 et pas k…
Reprends ton tableau d'avancement. A la demie réaction :
ξ=n1/2
ce qui conduit à une quantité totale de gaz égale à 5n1/4 soit à :
P=5P1/4
Regarde ton tableau de valeurs : cela parait réaliste sachant que le temps de demie réaction est d'environ 63s...
Ah d'accord.. j'avais perdu de vu que P(t) était la pression totale au cours du temps, je pensais que c'était la pression partielle en N2O..
Donc ma définition n'est pas bonne, ce n'est pas le temps pour lequel la moitié du réactif limitant a été consommé?
Pas de problème avec ta définition du temps de demie réaction. La quantité initiale de N20 étant n1, il ne reste plus que n1/2 mole de N20 à t=t1/2.
Donc c'est bon j'ai bien du ln(1/2) qui fait sortir un - en ecrivant ln(2) pour compenser - devant le k et j'ai bien:
ln(2)/k=t1/2
En reprenant mes calculs avec l'approximation:
k=1,0992 s-1 et j'obtiens que:
A 6,24*1014 s-1
6,24*1014 s-1
On est d'accord que le facteur d'Arrhenius est bien dans la même unité que k?
k2 4,04*102 s-1
4,04*102 s-1
Et enfin:
t'1/2 1,7*10-3 s
1,7*10-3 s 2 ms
2 ms




