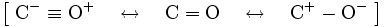Inscription / Connexion Nouveau Sujet
Le monoxyde de carbone
Bonjour!
Sur Wikipédia, j'ai pu trouver une image du monoxyde de carbone : l'atome de carbone et l'atome d'oxygène forment trois liaisons de covalence.
De plus, nous avons pour le carbone, un doublet non liant, et pour l'atome d'oxygène, il y a aussi un doublet non liant.
Du coup, en comptant le nombre d'électrons du carbone, nous obtenons 5 (Comment est-ce possible?) et pour l'atomme d'oxygène, nous en avons également 5.
L'atome d'oxygène, il a 6 électrons externes normalement, non? Comment se fait-il qu'il lui en reste 5 ? Aurait-il donner un électron à l'atome de carbone? Ce "don" d'électron est-il possible?
Merci!