Inscription / Connexion Nouveau Sujet
La structure du Cristal Nacl
bonjour j'ai une petite question , Est ce que quelqu'un pourrait m'expliquer la structure du cristal du sel j'ai regardez sur internet mais je ne comprend pas trop .
Tout d'abord quand tu commences à te demander qu'elle est la structure d'un cristal, tu t'intéresses au domaine de la cristalochimie, avec tout les termes et toutes les notions qui en découlent, comme la coordinence, la compacité, les notions de sites, d'empilements (compacts ou non) et de structure type entre autres.
Autrement dit, certains termes ou notions peuvent être dure à comprendre
Justement le cristal de sel est une structure type, que l'on appelle tout simplement "Structure de type Nacl".
Bien commençons par le commencement le sel est un cristal ionique. Ce qui est sensiblement différent d'une molécule simple comme le dioxyde de carbone. Le sel (ou NaCl) est composé d'anion Cl- et de cations Na+. Ces ions ne sont pas liés par des liaisons covalentes, mais par des liaisons "similaires", les liaisons ioniques (aussi appelées électrovalentes). Ces liaisons sont issues de l'attirance entre les cations chargés positivement et les anions chargés négativement (analogie : deux aimants).
Enfin le cristal de sel se dissout facilement dans dans l'eau (H2O est un ligand qui permet facilement la dissolution, je ne m'attarde pas sur le sujet ... Si tu veux des précisions n'hésites pas) selon l'équation : NaCl + H2O  Na+ + Cl- + H2O
Na+ + Cl- + H2O
Voilà pour le côté chimique et composition chimique. Ca à son importance ! Bien connaître un cristal, c'est aussi bien connaitre les éléments qui le composent.
Maintenant passons au vif du sujet, la structure du cristal NaCl.
Comme je l'ai dit précédemment c'est une structure type.
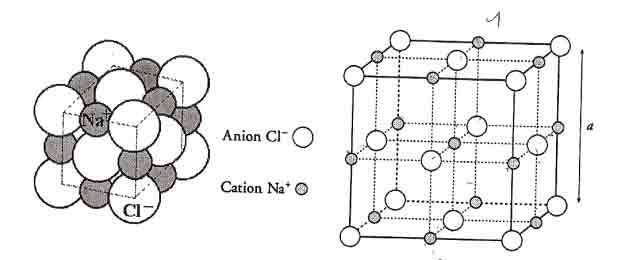
Une masse de sel est composée de n mailles cubique à faces centrées (CFC). Qu'est qu'une maille cubique faces centrées ? C'est une maille (en gros c'est un parallélépipède, composé de motifs qui se répètent dans un réseau infini pour ne pas entrer trop dans les détails) cubique dont chaque sommet et chaque centre de face portent un atome.
Dans notre cas chaque chaque sommet et chaque centre de face portent un anion Cl-. Quand aux cations Na+ ils se trouvent dans des sites octaédriques de la maille. Les sommets de chaque site octaédrique portent un anion Cl-
Enfin chaque maille se compose de 4 anions Cl- en propre*, et de 4 cations Na+ en propre*.
Pour résumer simplement, dans un cristal de sel, la maille de base :
- est généralement (par convention) cubique faces centrées : CFC.
- porte un anion Cl- sur chaque sommet et centre de face.
- porte un cation Na+ dans chaque site octaédrique, ou plus vulgairement : un sur chaque arrête et un au centre de la maille cubique (FC).
-> un ion dans cette maille a une coordinence (nombre de voisins proche) 6, un nombre d'atome en propre Z=4cat.+4an.= 8ions
On pourrait en dire beaucoup plus mais je pense qu'avec tout cela tu as déjà un bon panel d'informations.
Pour plus de précision tu peux visiter Wikipédia 

![]()
Enfin ci-joint une figure représentant la maille cubique type, d'une structure type NaCl.
Et sur ce bonne chance pour tes "approfondissements" sur le sujet  .
.
________
* Atomes en propre : C'est en gros le nombre d'atome présent dans une maille, sachant que dans une maille cubique (parallélépipède) :
- les atomes aux sommets comptent pour
- les atomes sur les arrêtes comptent pour
- les atomes sur une face comptent pour
- les atomes dans la maille compte pour