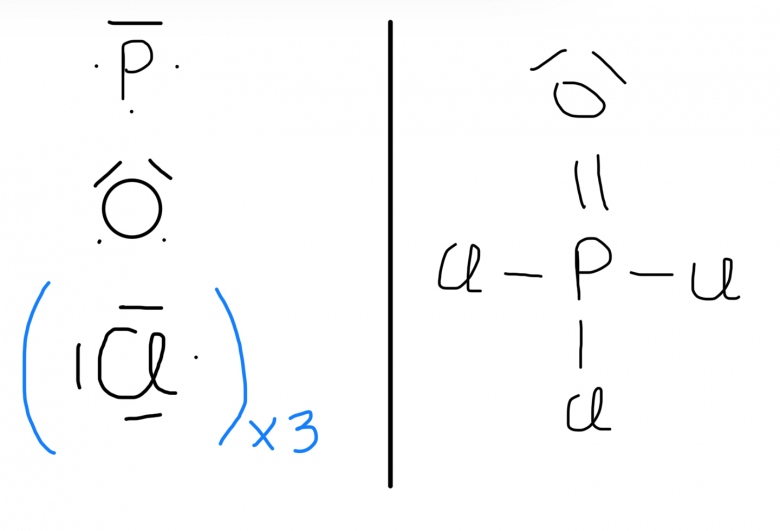Inscription / Connexion Nouveau Sujet
L’atome de phosphore
Bonjour, j'ai des questions concernant les liaisons que forme l'atome de phosphore 15P
1) Tous d'abord dans la molecule de POCl3 : img
Pourquoi P ne porte pas de charge 2- (POCl32-)
Car il est entouré de 10 electrons, il a un surplut d'electrons pourquoi on ne le montre pas?
2) Ensuite dans la molecule PF5 c'est exactement la meme question pourquoi ce n'est pas PF52-
(je sais qu'il existe des atome qui ne suivent pas la regle de l'octet : ils sont hypervalents mais est-ce que ca veut dire qu'on ne montre pas leur charge)
3) Enfin concernant le PF6-, je ne comprend pas comment P peut former 6 liaisons alors qu'il n'a que 5 electrons de valences (est-ce que ses electrons de coeur partcipe aussi aux liaisons? Et pourquoi forme-t-il 6 liaisons?)
Merci pour vos reponses cela m'aide beaucoup
Bonsoir
La formule de Lewis de gauche n'a pas de sens. Celle de droite est correcte mais incomplète. Commence par compter tous les électrons de valence auquel tu ajoutes 2 puisqu'il s'agit d'un ion négatif. La formule de Lewis doit faire figurer tous ces électrons ; tu as oublié les doublets libres sur les trois Cl.
Pour connaître la charge portée par un élément, tu compares le nombre d'électrons de valence de cet élément à son environnement électronique. Cet environnement compte 2 par doublet libre (logique : deux électrons non partagés) et 1 par doublet de liaison (logique : un doublet de liaison est partagé entre deux éléments).
Je te laisse réfléchir à tout cela et compléter...
Autour de P il y a 5 electrons de valences - Son environnement electronique est 5 car il y a 5 liaisons entre P et les autres atomes donc pas de charges pour P
OK pour l'environnement de P : on retrouve 5 électrons pour 5 électrons de valence donc pas de charge.
Pour chacun des Cl : il conviendrait de représenter aussi les trois doublets non liants (tu as bien représenté les doublets non liants pour O). Chaque Cl possède ainsi un environnement électronique de 7 pour 7 électrons de valence ; donc pas de charges non plus.
POCl3 est donc une molécule et non un ion comme indiqué dans ton premier message.
Si tu as le temps et si cela est à ton programme, tu pourrais t'entraîner à prévoir la structure géométrique de cette molécule par la méthode VSEPR.
Merci pour votre reponse - Je vais effectivement representé les doublet non liants des Cl (je les avaient oubliés) - VSEPR est bien au programme PASS
Pour cette molecule la geometrie est tetrahedrique
Oui pour la structure tétraèdrique. Les angles de liaisons ne sont pas rigoureusement égaux à 109°28'. Il est impossible de prévoir les valeurs précises des angles de liaisons. Il faut se fier à l'expérience. On demande parfois tout de même dans les concours de préciser les angles supérieurs à 109°28' et les angles inférieurs.