Inscription / Connexion Nouveau Sujet
Isomerie
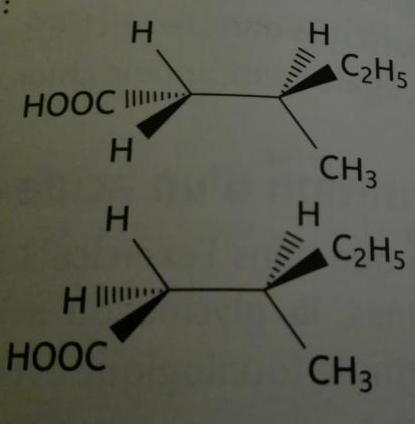
Bonjour, je bloqué sur une petite correction d'un exercice... Merci d'avance pour votre aide. On me dit ds la correction que ces deux molécules sont les mêmes mais pourtant elles n'ont pas la même géométrie dans l'espace, elles ne sont pas superposables.
Bonjour,
Si les molécules représentées par ta photo étaient rigides, tu aurais parfaitement raison :
N'étant pas superposables elles seraient des stéréoisomères.
Mais, il y a un "mais" qui fait que ces deux molécules sont bien, comme indiqué par la correction, les mêmes.
Mais imagine maintenant (schéma ci-dessous) que tout en maintenant fixe le carbone n°1 et les substituants qu'il porte (H, C2H5, CH3) tu fasses tourner le carbone n°2 et les substituants qu'il porte ( H, H, COOH ) autour de l'axe qui relie le carbone n°1 au carbone n°2
Tu vas vite te rendre compte qu'après une rotation adéquate, tu as rendu la molécule que tu fais tourner identique à l'autre.
C'est ce qui se produit à l'état naturel sous l'effet de l'agitation thermique. Cette molécule n'est pas rigide. Elle se déforme constamment et très rapidement.
Les chimistes appellent cela la " libre rotation carbone-carbone ".
Ils emploient aussi les termes de " conformères " ou encore " isomères de conformation "
Poue ensavoir davantage tu peux rechercher sur internet les termes soulignés
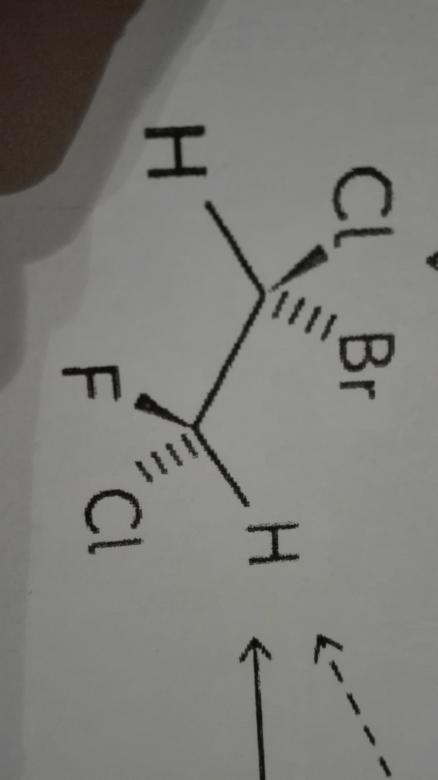
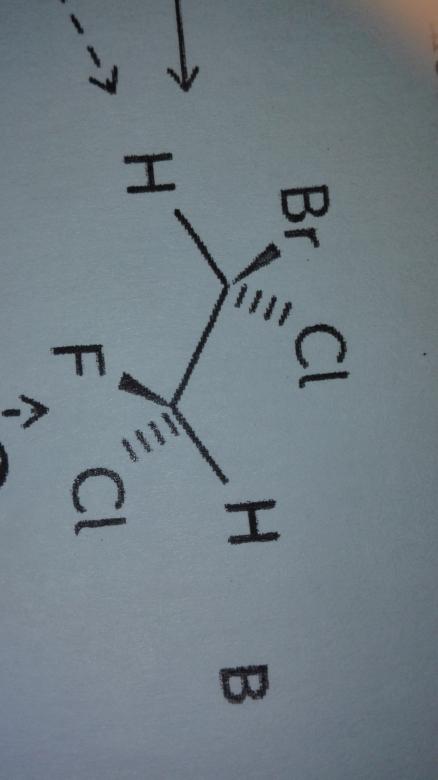
Merci beaucoup pour votre réponse mais il y a encore quelque chose que je ne saisis pas. Comment savoir si les molécules necessitent une rupture de liaison ou une simple rotation. Par exemple, celles la sont des des diastereoisomere mais on pourrait dire aussi qu'ils à eu une rotation sur leur carbone asymétrique...
Dans l'exemple que tu m'as proposé dans ton post du 04-04-18 à 19:31 , il suffisait de faire tourner l'un des atomes de carbone (1) ou (2) par rapport à l'autre de l'une des molécules pour obtenir l'autre.
Dans l'exemple que tu proposes ici, ce n'est plus la même situation : En faisant tourner l'un des atomes de carbone par rapport à l'autre de l'une des molécules on obtient jamais l'autre.
Les deux molécules ne sont pas superposables, ce sont des stéréoisomères.
Pourquoi une telle différence entre ces deux exemples en apparence si ressemblant ?
C'est parce que dans le premier cas que tu as exposé, l'un des atomes de carbone ( le n° 2 ) porte 3 substituants ( H, H, COOH ) dont deux sont identiques ( H et H )
En revanche dans le deuxièmes cas les deux atomes concernés (n° 1 et 2) portent des substituants tous différents (H, Cl, F dans un cas et Br, Cl, H dans l'autre cas)
Il est vrai qu'il est un peu difficile de visualiser tout cela en 2D alors que la différence devient évidente en 3D
Une solution efficace est de te bricoler des modèles moléculaires avec des allumettes ou des cure-dents et des boules de pâte à modeler de couleurs différentes. Tu verras alors clairement la différence entre les deux situations.
Encore mieux : Demande à ton professeur des modèles moléculaires. Ils sont parfaits pour visualiser tout cela.
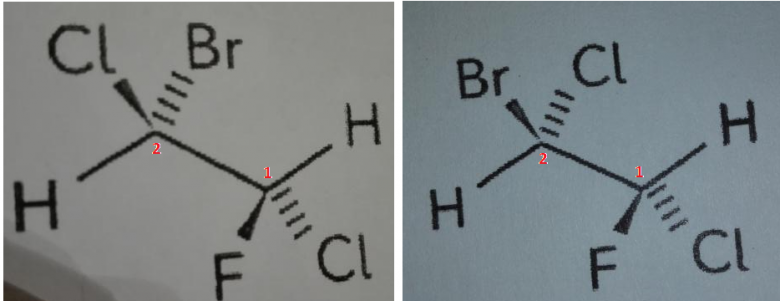
Merci beaucoup !!! J'ai enfin compris ce qui me posait gaipeent question ! J'ai finalement trouvé une manière simple de différencier une même molécule et des diastereoisomeres ce qui complète ce que vous l'avez dit. C'est de faire une représentation que j'avais déjà rencontre dans un exercice de la molécule de face à plat comme cela et ça aide vraiment à d'imaginer la molécule dans l'espace. Merci encore !!!
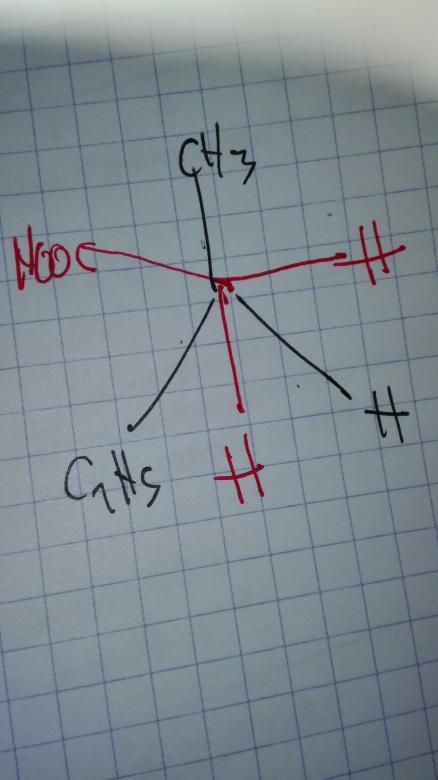
Oui !
Ce type de représentation est appellé "projection de Newman"
J'aurais volontiers utilisé cette représentation si je m'étais douté que tu l'avais déjà rencontrée.
En principe, elle n'est pas au programme de terminale, mais elle est effectivement très commode.
Il existe de nombreux sites internet qui évoquent ce type de projection comme par exemple celui ci : ![]()