Inscription / Connexion Nouveau Sujet
Interaction de NH3 avec un protons
Bonjour
J'ai une question concernant NH3 :
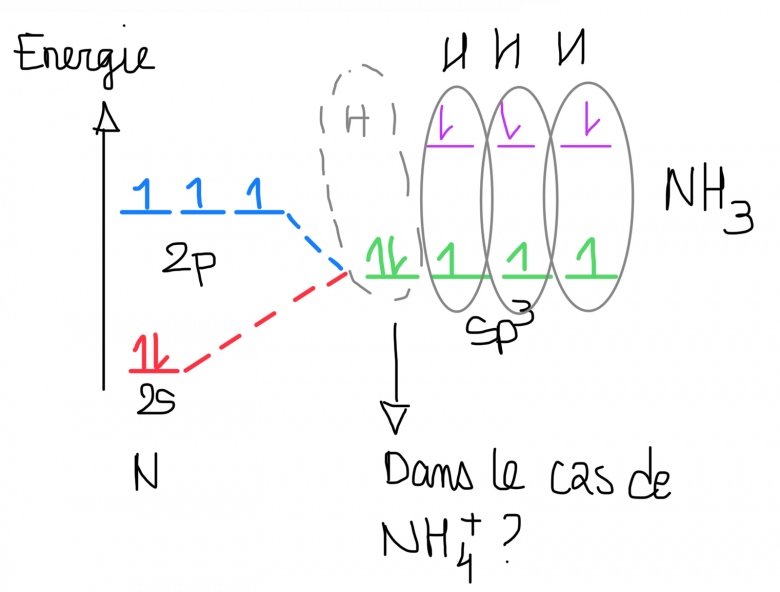
La configuration electronique de N est [He] 2s22p3 soit 5 electrons de valences. Dans la molecule de NH3, N est hybridé sp3 (img) et il est ecrit que le doublet non liant (dans la premiere case sp3) peut interagir avec un protons pour devenir NH4+ or je ne comprend pas car je croyais que seul les electrons celibataire pouvaient former des liaisons (ceux qui sont représentés par un seul spin) - ou va le deuxieme electrons sur ce diagramme pour que NH4+ puisse se former
Le protons est un H+ (donc il n'a pas d'electron) ainsi N met en comment sont doublet non liant avec H+ pour former la liaison mais alors pourquoi est-ce que cette liaison n'est pas representé par une fleche (car les deux electrons viennent d'un seul atome et donc ca serait une liaison coordonnée) et aussi comment est-ce que c'est representr sur le diagramme
Merci
Bonjour
As-tu entendu parler de liaison covalente de coordination, ce qu'on appelait autrefois liaison covalente dative ?
vanoise Bonjour,
C'est quand la paire d'electrons qui forme la liaison vien d'un seul atome et on la reprensente avec une fleche
Donc dans le NH4+ c'est une liaison coordonnée et c'est pour ça qu'il y a un plus ducoup (car N partage un electrons de son douclet non liant avec H+ (qui n'a aucun electron))
C'est cela. A noter qu'une liaison de coordination ne diffère d'une liaison covalente ordinaire que par son mode de formation. Une fois la liaison covalente formée, ses propriétés sont exactement les même. On obtient une structure tétraédrique très analogue à celle du méthane. D'ailleurs l'ion ammonium et la molécule de méthane possède exactement le même nombre d'électrons.
A noter que l'établissement possible de cette liaison explique le caractère basique de l'ammoniac et donc le comportement acide de l'ion ammonium.


