Inscription / Connexion Nouveau Sujet
influence du pH précipitation
Bonsoir,
Ce matin j'ai eu colle de physique et j'ai eu la question suivante :
Soit une solution saturée en CaCO3(s) pour laquelle on mesure un pH égal à 9,95. Calculer Ks.
Donnée : le pKa du couple HCO3-/CO32- vaut 10,3.
J'ai écrit CaCO3(s) = Ca2++CO32-
Ensuite si je me souviens bien le prof m'a dit que comme on n'était dans le domaine de prédominance de HCO3- on devait tenir compte de la réation :
H20 + CO32- = HO- + HCO3-
Est-ce que vous pourriez m'expliquer un peu plus pourquoi s'il-vous-plaît ? Est-ce que ça fonctionne toujours comme ça ?
(C'est ce que je me souviens de l'énoncé et de ce que j'ai fait ce matin à 8h donc il est possible qu'il y ait des erreurs )
)
Merci d'avance pour vos explications !
Bonsoir
Souvent lorsqu'il faut calculer un pH, on fait des hypothèses simplificatrices puis, une fois le calcul fait, on vérifie que le résultat est cohérent avec les hypothèses de départ. Ici la situation est beaucoup plus simple puisque le pH est fourni. La notion de domaine de prédominance permet à coup sûr d'affirmer les choses suivantes.
1° : Le pH est un peu inférieur au pKa du couple HCO3-/CO32- mais nettement supérieur au pKa du couple H2CO3/HCO3-. On peu donc négliger la seconde basicité. Les deux réactions à prendre en compte sont donc la réaction de dissolution et la réaction des ions carbonate sur l'eau comme tu l'as écrit. Ce qui conduit aux deux relations à l'équilibre :
2° : Le passage en solution d'un ion calcium s'accompagne du passage en solution d'un ion carbonate qui, soit reste en solution soit se transforme en ion hydrogénocarbonate :
3) : Le pH étant nettement supérieur à 7,5, on peut négliger l'influence de l'autoprotolyse de l'eau. La formation d'un ion hydrogénocarbonate s'accompagne de la formation d'un ion hydroxyde :
Avec tout cela, tu dois pouvoir terminer...
Je pense que je me suis mal exprimée. En fait, ce qui me pose problème ce n'est pas la résolution "finale" de l'exercice. C'est juste que je ne comprends pas pourquoi le fait qu'on soit dans le domaine de prédominance de HCO3- fait qu'on doit tenir compte de la 2e réaction que j'ai écrite. Parce-que logiquement si on est dans le domaine de prédominance de HCO3-, c'est qu'il y a très peu de CO32- du coup j'aurais plutôt tendance à dire que la 2e réaction peut être négligeable. En fait, dans ce type d'exo où il y a un mélange entre précipitation et acide-base j'ai remarqué que :
- si on est dans le domaine de majorité de l'espèce acide-base constituant le solide : on ne tient pas compte de la réaction acide-base faisant intervenir cette espèce.
- si on n'est pas dans le domaine de majorité de l'espèce acide-base constituant le solide : on tient compte de la réaction acide-base faisant intervenir cette espèce.
Est-ce que ce schéma est toujours juste ou du moins juste tout court ? Si oui, pourquoi ?
comme on était dans le domaine de prédominance de HCO3-
Désolé : cette phrase aurait dû m'alerter sur ta mauvaise compréhension de la notion de domaine de prédominance dès le début !
Parce-que logiquement si on est dans le domaine de prédominance de HCO3-, c'est qu'il y a très peu de CO32- du coup j'aurais plutôt tendance à dire que la 2e réaction peut être négligeable.
Cette phrase est à la fois fausse et illogique : considérer que le pH appartient au domaine de prédominance de HCO3- doit logiquement conduire à dire que la réaction des ions carbonate sur l'eau est quasi totale et non pas négligeable !
Je reprends donc à zéro la notion de domaine de prédominance. Il y a trois situations différentes envisageables et non pas deux comme tu l'écris.
Première situation envisageable : pH>(pKa+1) : c'est le domaine de prédominance de CO32-. Il est possible de négliger la présence de HCO3-, c'est à dire la seconde réaction. Tu as :
Le pH se calcule comme celui d'une monobase très faiblement dissociée de concentration
Deuxième situation envisageable : (pKa-1)
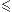 pH
pH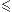 (pKa+1)
(pKa+1)
Ni la base ni l'acide n'est prépondérant. Il faut tenir compte de la présence à la fois de CO32- et de HCO- . C'est la situation à considérer ici, celle que j'ai développée dans mon message précédent.
Troisième situation envisageable : pH<(pKa-1) tout en étant supérieur à pK'a+1, pK'a désignant le pKa du couple H2CO3/HCO3-. C'est le domaine de prédominance de HCO3-. la réaction des ions carbonate sur l'eau est quasi totale, ce qui conduit à :
C'est beaucoup plus clair maintenant  Mais du coup, même si mon raisonnement était faux, quand on est dans le domaine de prédominance de HCO3- on a forcément très peu de CO32- parce-qu'il sont consommés de façon totale par la réaction 2, non ? Ensuite, est-ce que tu pourrais me dire si ce qui suit est juste pour vérifier que j'ai bien compris le raisonnement :
Mais du coup, même si mon raisonnement était faux, quand on est dans le domaine de prédominance de HCO3- on a forcément très peu de CO32- parce-qu'il sont consommés de façon totale par la réaction 2, non ? Ensuite, est-ce que tu pourrais me dire si ce qui suit est juste pour vérifier que j'ai bien compris le raisonnement :
Pour pH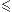 pKa-1 : comme on est dans le domaine de prédominance de HCO3-, on considère que la réaction 2 est totale du coup on peut négliger [CO32-] et donc on peut "sommer" les réactions 1 et 2 pour obtenir une unique réaction.
pKa-1 : comme on est dans le domaine de prédominance de HCO3-, on considère que la réaction 2 est totale du coup on peut négliger [CO32-] et donc on peut "sommer" les réactions 1 et 2 pour obtenir une unique réaction.
Pour pKa-1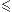 pH
pH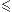 pKa+1 : la réaction 2 n'est pas totale donc on en tient compte car on a à la fois coexistence de CO32- et HCO3- .
pKa+1 : la réaction 2 n'est pas totale donc on en tient compte car on a à la fois coexistence de CO32- et HCO3- .
Pour pH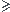 pKa+1: la réaction 2 est totale dans le sens indirect mais on ne tient pas compte de la réaction totale dans le sens indirect car elle fabrique des CO32- qui se trouvent dans la réaction 1 qu'on étudie. Le truc que j'ai du mal à comprendre c'est que du coup, dans le 1er cas, on tient compte de la réaction 2 car elle va former des HCO3- qui vont modifier la concentration de CO32- par rapport à Ca2+. Du coup, dans ce dernier cas, on ne dit pas que la réaction inverse modifie [CO32-] car dans ce cas-ci on n'a pas de HCO3- en solution. Par contre si jamais on en avait, on ne pourrait pas négliger la seconde réaction ?
pKa+1: la réaction 2 est totale dans le sens indirect mais on ne tient pas compte de la réaction totale dans le sens indirect car elle fabrique des CO32- qui se trouvent dans la réaction 1 qu'on étudie. Le truc que j'ai du mal à comprendre c'est que du coup, dans le 1er cas, on tient compte de la réaction 2 car elle va former des HCO3- qui vont modifier la concentration de CO32- par rapport à Ca2+. Du coup, dans ce dernier cas, on ne dit pas que la réaction inverse modifie [CO32-] car dans ce cas-ci on n'a pas de HCO3- en solution. Par contre si jamais on en avait, on ne pourrait pas négliger la seconde réaction ?
et donc on peut "sommer" les réactions 1 et 2 pour obtenir une unique réaction.
Cette "somme" peut être utile pour faire le bilan des espèces majoritaires mais il faut tenir compte des deux équilibres si le but de l'exercice est la mesure de Ks.
Pour le reste, je me demande si le plus simple ne consiste pas à faire le raisonnement complet comme je l'ai fait dans mon message du 11-01-19 à 19:45.
Les trois cas envisageable concernant uniquement la simplification ou non de l'équation n° 2 :
premier cas : pH>pKa+1 : HCO3- négligeable :
deuxième cas : pKa-1<pH<pKa+1 : pas de simplification
troisième cas : CO32- négligeable devant HCO3- mais il faut malgré tout tenir compte de ces ions pour l'expression de Ks.
D'accord merci je pense avoir compris. Mais même si ce que j'ai écrit n'est pas forcément le plus judicieux est-ce que c'est tout de même juste stp ?
Ce que tu as écris me semble correct mais je trouve que ton dernier paragraphe complique la situation sans apporter grand'chose de concret.


