Inscription / Connexion Nouveau Sujet
Influence de la température : enthalpie de dissolution
Bonjour,
J'ai une question un peu courte, mais je fais actuellement un exercice dans lequel, après avoir calculé des enthalpies de dissolution, on me demande l'influence de la température sur les réactions de dissolutions associées à ces dernières.
Exemple : KCN --> K+ + CN-
J'ai trouvé une enthalpie de dissolution de -10 kJ/mol à l'aide d'un cycle de Born-Haber (ce qui me paraît un peu étrange d'ailleurs, car en cherchant la valeur sur Wikipedia, je trouve une valeur de 11,72 kJ/mol).
Concernant l'influence de la température, je ne trouve pas autre chose à dire que la température va permettre de faire la dissolution en apportant de l'énergie.
Mais dans le cas où l'enthalpie de dissolution serait positive, que pourrait-on dire ?
PS : avec la loi de Van't Hoff, on pourrait relier Ks à l'enthalpie de dissolution, mais je ne l'ai pas vu dans le cadre du cours en particulier pour lequel je fais l'exercice... (je l'avais vu durant un autre semestre dans une autre matière).
Bonjour
Le Handbook fournit lui aussi une enthalpie molaire de dissolution de +11,72kJ/mol. La dissolution est donc un processus endothermique pour ce composé.
Si tu veux, tu peux détailler le raisonnement qui t'a conduit à une valeur négative.
Sinon, la loi qualitative de modération de Van t'Hoff affirme qu'à pression constante, une augmentation de température favorise le déplacement d'un équilibre dans le sens endothermique.
Ok, merci !
Si j'ai bien compris, pour une réaction exothermique, une augmentation de température défavoriserait la réaction, et pour une endothermique, cela la favoriserait.
Je poste mon raisonnement, voici les données qu'on me donne :
Enthalpie d'hydratation de K+ (g) : -322 kJ/mol
Enthalpie d'hydratation de CN- (g) : -370 kJ/mol
Energie réticulaire de KCN(s) : 682 kJ/mol.
J'ai fait le cycle (voir image), et ai trouvé :
.
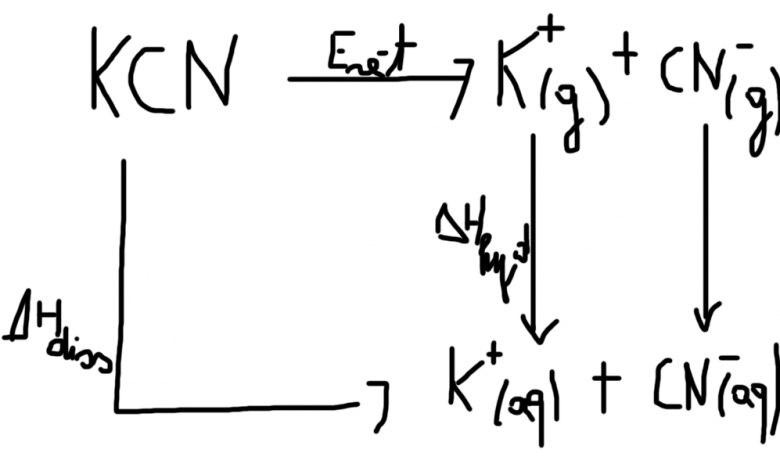
Ton raisonnement est correct. Le problème vient sûrement des données thermodynamiques fournies. Ce genre de mesures est assez délicat et les valeurs fournies diffèrent largement en fonction des sources. Si la valeur de l'enthalpie de dissolution de K+ semble faire consensus, j'ai noté de grandes disparités concernant celle de CN- : les valeurs que j'ai trouvées sont autour de -330kJ/mol. Je n'ai pas trouvé d'info sur l'énergie réticulaire .


