Inscription / Connexion Nouveau Sujet
gaz parfait (thermodynamique)
Bonjour!
Dans notre cours de thermodynamique on a : un gaz parfait monoatomique est constitué d'un ensemble d'atomes considérés comme des particules ponctuelles sans interaction entre elles . Les interactions extérieures comme le poids qui pourraient influencer cette répartition sont négligeables . Est-ce que ça veut dire qu'on ne prend pas en considération le poids ? Mais alors en statique des fluides quand on considère l'atmosphere un gaz parfait dans la loi de Boltzman , quand on applique la relation fondamentale de la statique gradP=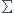 des forces volumiques, on devrait obtenir grad P = dP/dz=0 puisque la seule force volumique est le poids qu'on a négligé
des forces volumiques, on devrait obtenir grad P = dP/dz=0 puisque la seule force volumique est le poids qu'on a négligé  :? ce qui est evidemment faux puisque la pression change avec l'altitude !! Je comprend pas
:? ce qui est evidemment faux puisque la pression change avec l'altitude !! Je comprend pas 
Bonjour
Excellente question qui ne manque pas de subtilité !
A mon avis, il faut distinguer deux choses :
1° : Le modèle du gaz parfait habituellement utilisé en thermodynamique macroscopique : il s'agit d'un gaz idéal qui possède les deux propriétés suivantes :
- vérifier l'équation d'état bien connue
- vérifier les deux lois de Joule : (U et H ne dépendant que de T)
Ce modèle a l'avantage de bien représenter la réalité tant que la pression des gaz reste faible et que les conditions de température et de pression sont éloignées des conditions de liquéfactions.
2° : le modèle du gaz parfait utilisé en thermodynamique statistique qui est un peu plus restrictif : le gaz est nécessairement homogène : la pression et la température gardent des valeurs identiques en tout point du gaz. Il s'agit d'une approximation valide lorsque les dimensions du récipient contenant le gaz sont faibles : les variations de T et p avec l'altitude peuvent être négligées.
D'ailleurs, de façon générale, tu fais souvent cette approximation, lorsque tu considères un gaz enfermé dans un cylindre par exemple. Tu la fais à chaque fois que tu parles de LA température et de LA pression du gaz sans préciser en quel point du gaz les mesures sont faites...
Bref : il te suffit de rajouter dans ton cours que la théorie faite ne s'applique qu'aux gaz parfaits homogènes...


