Inscription / Connexion Nouveau Sujet
Formule Lewis d'une molecule ionique
Bonjour,
Je suis actuellement en PACES(Première année commune aux étudiants en santé).J'ai un petit problème en chimie, concernant la structure de Lewis.Notre professeur nous a donné comme exercice de trouver la représentation selon Lewis la plus probable de ces molécules ioniques:1)[SF2O2]2-
2)[BrO3]3-.
1)J'ai commence par les bases, trouver le nbe d'e- de chq atome.
S:6 F:7 O:6
Puis de calculer le nbe d'e- total qui vont s'associer
N=6+2*7+2*6+2=34
Et le nbe de doublet est N'=34/2=17
Et c'est là que je cale, comment les placer ces doublets, qui seront les non liantes, qui les liantes, qui seront les liaisons multiples?
Merci dav a ceux qui voudrons m'aider
Bonsoir
Attention : il s'agit d'ions et on prend en compte seulement les électrons périphériques : c'est à dire les électrons de valence.
L'idée générale consiste à les répartir en respectant au mieux la règle de l'octet sachant que cette règle peut ne pas être respectée pour l'atome central.
Je te laisse réfléchir et faire des propositions.
Petite mise au point par rapport à mon précédent message : il s'agit bien, comme je l'ai écrit, de ne prendre en compte que les électrons de valence et non, comme tu l'as écrit : "les électrons des atomes". Les électrons des couches internes n'interviennent pas.
Cependant, c'est bien le calcul que tu as fait : en tenant compte des 2 électrons supplémentaires apportés par la ionisation, il s'agit bien de positionner 17 doublets d'électrons.
Un peu d'aide à la réflexion : essaie de positionner S comme atome central dans le premier cas et Br dans le second cas.
Voila ce que J'ai obtenu pour la première molécule. Comble, où placer le 17 eme doublet alors que le règle d'octet est satisfait pour tous les atomes?
Tu y es presque mais attention : je ne compte que 16 doublets de valence et pas 17 !
Autre remarque : il est d'usage de signaler les excès de charges négative ou positive lorsqu'elles sont localisées sur un ou plusieurs atomes précis par ou
Pour t'aider un peu, j'ai trouvé sur le net un exercice niveau PACES sur cet ion. C'est le n° 10. Posé ainsi, il est plus simple ; tu peux commencer par éliminer les structure ne faisant pas apparaître 17 doublets de valence. Ensuite, pour trouver la structure la plus probable, il faut tenir compte de la différence d'électronégativité entre ces trois atomes : S est le moins électronégatif, O est un peu plus électronégatif et F est le plus électronégatif. La structure la plus probable ferait donc apparaître les deux charges négatives sur les deux atomes F mais il n'est pas possible de positionner 17 doublets dans ce cas. Donc, entre une structure faisant apparaître les charges - sur S et une structure faisant apparaître les charges - sur O, la dernière est la plus probable.
![]()
Merci beaucoup.
D'ailleurs, puisque notre prof nous a dit d'emmagasiner un max de sujet car on n'aura pas le temps de faire des exos. Est-ce que vous sauriez où puis-je en trouver? Même sans corrections c'est mieux
As-tu lu la référence que je t'ai indiquée dans mon message de 11h43. Il y a de quoi t'occuper pendant un bout de temps !
Desole de ne répondre que maintenant.
Problème de login.
Je reprend avec la molecule de [SF202]2-
Je me suis référé aux QCMs que vous m'avez envoye
Voilà ce que je choisis
Je n'ai pas encore mis les charges de xhaque atome.
J'ai placé le dernier doublet sur S[quote]
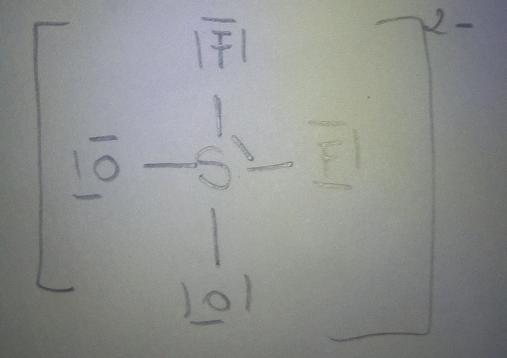
Just pour faire le point
Est-ce que j'ai raison?
Lorsqu'on place les doublets:
1) On place d'abord les doublets liants
2) puis les doublets non liants s'il en reste
3) s'il en reste encore, on place les doublets sur l'atome central
Et quand Est-ce qu'on a recours aux doublets multiples?
C'est cela, après bien sûr avoir dénombré la totalités des électrons de valence.
Ce que tu as écrit doit se faire en respectant, autant que possible la règle du duet pour H et la règle de l'octet pour les autres éléments, sachant bien sûr qu'il existe des exceptions à cette règle de l'octet.
Lorsque plusieurs formules sont théoriquement possibles en respectant ces règles, privilégier la formule où les charges formelles sont en accord avec les différences d'électronégativités des éléments chimiques.



