Inscription / Connexion Nouveau Sujet
Force de pression
Bonjour,
J'essaie de prouver que la pression cinétique d'un gaz vaut p=(1/3)mnu², où :
m est la masse d'une particule, n est la densité moléculaire c'est-à-dire la nombre de particules par unité de volume, et u la vitesse quadratique moyenne des particules.
J'ai la correction sous les yeux. On commence par considérer un élément de surface dS, et on imagine une particule de masse m à la vitesse v qui est prête à entrer en contact avec dS, donc à faire un choc, au point M dS. Disons que l'axe (Oz) est normal à la surface, avec les z croissants du gaz vers la paroi, et disons que la particule fait un angle
dS. Disons que l'axe (Oz) est normal à la surface, avec les z croissants du gaz vers la paroi, et disons que la particule fait un angle  avec (Oz), donc
avec (Oz), donc 
 ]-
]- /2;
/2; /2[ puisque la particule arrive sur la paroi.
/2[ puisque la particule arrive sur la paroi.
Après le choc, la particule repart à une vitesse v', en faisant un angle  '
' ]
] /2;3
/2;3 /2[.
/2[.
Disons que le choc se passe entre t et t+dt.
On considère la force vect(f) exercée par la paroi sur la molécule lors du choc.
La correction invoque la loi de la dynamique en disant :
 t
t t+dtvect[f(t')]dt'=m(
t+dtvect[f(t')]dt'=m(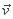 '-
'-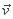 )=m(v'cos
)=m(v'cos '-vcos
'-vcos ).
).
Pourriez-vous m'expliquer comment on obtient cette relation ? Merci.
PS : p=(1/3)mnu² est-il valable seulement pour un gaz monoatomique ?
Cette relation est le principe fondamental de la dynamique, intégré.
La composante verticale de la quantité de mouvement est inchangée, pour la composante horizontales, vous avez les projections. Habituellement, on considère juste que la composante horizontale change de signe.
Ah oui je vois merci.
En fait je ne sais pas pourquoi, mais en raisonnant avec les quantités de mouvement et non pas la vitesse alors c'est plus clair (pourtant c'est la même chose à un facteur m près...)
f=dp/dt
 t
t t+dtf(t')dt'=
t+dtf(t')dt'= t
t t+dt(dp/dt)dt'
t+dt(dp/dt)dt'
 t
t t+dt=p(t+dt)-p(t)
t+dt=p(t+dt)-p(t)
 t
t t+dt=mv(t+dt) -mv(t)
t+dt=mv(t+dt) -mv(t)
 t
t t+dt=m(v'-v)
t+dt=m(v'-v)
(il faut imaginer les flèches des vecteurs)
Cool merci ! 
Tant mieux si vous comprenez mieux avec les quantités de mouvement, parce que c'est avec elles qu'il faut raisonner 


