Inscription / Connexion Nouveau Sujet
Exercice type BAC TST2S
Bonjour j'aurais besoin de votre aide à propos de cette exercice que j'ai du mal à rédiger.
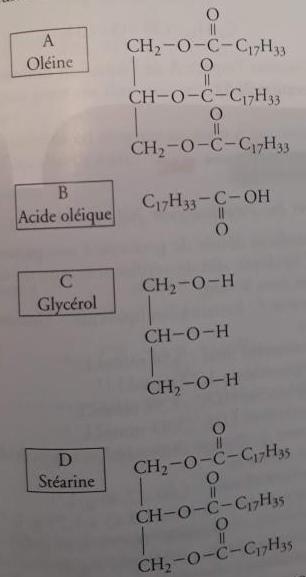
1) On hydrogène 442 g d'oléine
a) Quel est le nombre de moles d'oléine utilisée ?
On sait que n = m/M
On calcul : n = 442 / 884 = 0,5 moles
Seulement le résultat me semble étrange...
b) Quel est le nombre de moles de dihydrogène nécessaire si la réaction est totale ?
c) Quel est le volume de dihydrogène utilisé si le volume molaire de gaz dans les conditions de l'expérience est Vm L.mol-1
Question 1:
Etrange ?
Pourquoi étrange ?
Ce résultat "étrange" est exact.
1 mole d'oléine a une masse de 884g puisque M(oléine) = 884 g/mol
et il me semble parfaitement normal qu'une demi-mole de ce composé ait une masse de 442g
Il faut maintenant écrire l'équation d'hydrogénation de l'oléine.
C'est indispensable pour répondre aux questions 2 et 3
Non.
Il faut lire l'énoncé.
Il dit (ligne 1) : " On hydrogène de l'oléine. "
La réaction est donc une réaction d'hydrogénation de l'oléine.
Il te faut aller voir dans ton cours ce qu'est une réaction d'hydrogénation et quel est le produit formé dans le cas de l'hydrogénation de l'oléine.
Ayant ainsi identifié les réactifs et le produit (il n'y en a qu'un seul ) tu auras les éléments indispensables pour écrire ton équation chimique.
la reaction d'hydrogénation est une réaction chimique qui consiste à ajouter une molécule de dihydrogène (H2)
Voilà qui est parfait ! 
Tu te souviens probablement avoir calculé que 0,5 mol d'oléine était utilisée pour cette hydrogénation (C'est le résultat qui te semblait étrange ... )
Alors, toujours en jetant un simple coup d'il sur les coefficients stchiométriques de la réaction tu vas en déduire la réponse à la question b) de cet exercice.
Les nombres de moles disparus des réactifs et les nombres de moles apparus des produits sont proportionnels aux coefficients stchiométriques .
Vm = 24L/mol est le volume molaire des gaz dans les conditions de température et de pression.
Cela signifie que pour ces conditions de température et de pression 1 mole d'un gaz quelconque occupe un volume de 24L
Or, le dihydrogène est un gaz.
Tu n'auras pas de mal à calculer le volume de ce gaz qui a été utilisé.
Presque.
le L/mol est utilisé pour le volume molaire ( volume d'une mole)
mais ici le volume gazeux n'est pas celui d'une mole.
Le résultat sera exprimé en litres (L)
Ainsi on aura utilisé 36L de dihydrogène pour hydrogéner 0,5 mol ( ou 442g ) d'oléine



