Inscription / Connexion Nouveau Sujet
Exercice thermodynamique - Pression
Bonjour, j'ai un exercice de thermodynamique à faire mais je n'arrive pas à trouver la loi me permettant de réaliser l'exercice.
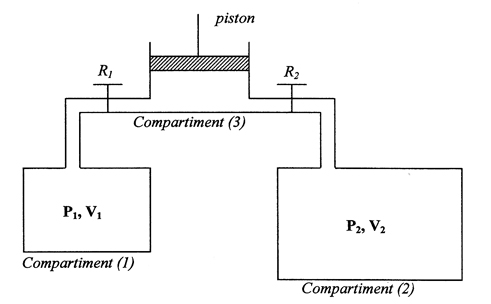
Voila l'énoncer : On peut transférer un gaz de façon progressive du compartiment (1) au compartiment (2) à l'aide de ce dispositif (Voir schéma).
Phase d'aspiration : Au départ, le piston est au fond du compartiment (3), R1 est ouvert et R2 est fermé. Le piston est remonté lentement par un opérateur jusqu'à sa position finale délimitée par un volume V=20L dans le compartiment (3).
Phase de refoulement : Le robinet R1 est fermé, R2 est ouvert. L'opérateur enfonce lentement le piston jusqu'à ce qu'il retrouve sa position initiale au fond du compartiment (3).
Dans l'état initial, les compartiments (1) et (2), de volume respectif V1=100L et V2=200L, renferment des gaz parfaits aux pression P1(0)=P2(0)=P0=1 atm. (Le piston dans l'état initial est au fond du compartiment (3)). La température est maintenue constante tout au long de l'experience. On néglige le volume des parties reliant les différents compartiments.
J'ai besoin d'aide uniquement pour la première question, je saurai me débrouiller pour le reste.
Question 1 : Exprimer les pressions P1(1) et P2(1) après un aller retour du piston puis calculer leurs valeurs numériques.
J'avais pensé utiliser la loi de Boyle-Mariotte, mais la quantité de matière à l'intérieur des récipients n'est évidemment pas constante. Peut-être appliquer la loi des gaz parfaits, mais je ne vois pas comment...
Je vous remercie d'avance pour votre aide 
Je pense que la loi des gaz parfait doit suffir. Après un aller retour du piston, il a 20l de moins dans le compartiment 1 et 20l de plus dans le compartiment 2. A moins que je ne dise n'importe quoi?
PV=nRT soit P1=nRT/V
Après un aller-retour P1(1)=nRT/(V-20l)
C'est ce que je pensais faire, mais le soucis est que je dois calculer la valeur numérique de P1 et P2 après un refoulement, mais je ne connais malheureusement ni la quantité de matière de gaz (Etant donné que je ne connais pas sa nature) ni la température au moment de l'expérience.
En plus, la relation ne semble pas coller avec les questions suivantes.
En fait, je pense que c'est encore différent et qu'il faut en fait se servir de Boyle-Mariotte. Lorsque le gaz est aspiré dans le compartiment (3), cela revient au même que d'étendre le volume du compartiment (1) à 20L (Soit 120L) sans changer la quantité de gaz à l'intérieur du réservoir. On peut donc écrire que
Par contre, là où j'ai un problème, c'est pour calculer la nouvelle valeur de après refoulement. Je sais qu'il y a 20L de gaz de pression
dans le compartiment (3) et qu'il y a 200L de gaz de pression
dans le compartiment (2). Il faudrait calculer la nouvelle pression (2-3) lorsque l'on ouvre le robinet
et appliquer la même méthode que pour calculer
. Peut-être avec la loi de Dalton ?
Merci de votre aide.


