Inscription / Connexion Nouveau Sujet
Exercice Thermochimie
Bonjour !
Il me reste 1 petite question d'un DM à résoudre mais j'ai beau me renseigner sur d'autres sites je ne trouve pas la démarche à suivre.
Voici la question :
Calculer l'enthalpie standard de réaction de la réaction de réduction de l'alcool méthylique en méthane :
CH3OH(l)+H2-->CH4 (g)+H2O(l)
Et voici les données fournies avec l'énoncé :
Enthalpies standard de combustion:
 cH°(CH3OH(l)) = -763 kJ.mol-1
cH°(CH3OH(l)) = -763 kJ.mol-1
 cH°(CH4 (g)) = -890 kJ.mol-1
cH°(CH4 (g)) = -890 kJ.mol-1
 cH°(H2 (g) = -286 kJ.mol-1
cH°(H2 (g) = -286 kJ.mol-1
J'essaye de faire des cycles thermodynamique pour résoudre , mais je ne sais pas par où partir !
En vous remerciant d'avance d'une quelconque réponse !
Bonsoir
J'écris les trois réactions de combustion :
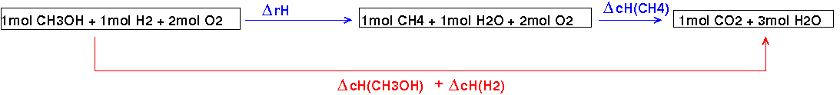
On envisage maintenant la transformation schématisée ci-dessous obtenue par deux « chemins » différents. L'enthalpie étant une fonction d'état, on obtient :
Remarque : mon logiciel de dessin peine à reproduire les "°" des grandeurs standard... Cela ne devrait pas te gêner...
Ouah j'en attendais pas autant ! Merci beaucoup à tous !
Et merci beaucoup pour le schéma Vanoise, il est tip top !
J'en profite pour vous demander si ma démarche et mon résultat à l'air probable :
On étudie l'équilibre en phase gazeuse : 2 SO3(g) <==> 2 SO2(g) + O2(g)
Dans un réacteur vide de volume fixe, on chauffe de l'anhydride sulfurique SO3(g) à 900 K. A l'équilibre, la pression s'établit à 105 Pa et la fraction molaire de O2(g) est X (O2(g)) = 0,13. Calculer la valeur de la constante d'équilibre à cette température.
Ducoup j'utilise la formule:
K° (T) =  ai, éqni
ai, éqni
Ce qui me donne : n²(SO2).n(O2)/n²(SO3)*Pt/n.P°=(2²*1)/4*105/(5*105)=1/5
Suis-je bon ?
Bonsoir
Ta formule littérale est bonne mais je ne comprends pas tes applications numériques... On peut raisonner directement sur les fractions molaires. L'état initial correspondant à du SO3 seul :
Remarque : pour une autre fois, il sera préférable de créer un post par exercice ; le forum est ainsi plus facile à consulter par d'autres étudiants intéressés par le sujet.


