Inscription / Connexion Nouveau Sujet
Exercice sur la solubilité
Data:
Gibbs free energies of formation of components int standard conditions (25 c, 1 bar) in KJ/mol:
AL3+(aq)=-485,3 ; H2O(liquid)=-237,14
R=8,315J/mol.K
chemical reaction and associated constants:
AL(OH)3(S)gibbsite + 3H+ = AL3+(aq) + 3H2O log Ks=+8.23
ALOH2+(aq) = AL3+(aq) + OH- log K1= -9.00
AL(OH)2+(aq) = AL3+(aq) + 2OH- log K2 =-18.24
AL(OH)°3(aq)= AL3+(aq) + 3OH- log K3= -25.79
AL(OH)-4(aq) = AL3+ + 4OH- log K4 = -32.73
for caculations, activities and concentrations will be equal for aqueous species.
1°) Demonstrate and give the equations allowing plotting the distribution of the different species of aqueous aluminum ( AL3+ ; AL(OH)+2; AL(OH)°3 and AL (OH )-4) versus PH. Plot this diagram.
2°) Give a general definition of the solubility of a mineral. which unit you can use for this parameter?
3°) Give the equation (By demonstrate it) you can use to calculate the solubility of gibbsite as a function of pH.Plot this graph and indicate directly on the diagram the stability domains of the mineral and the different aqueous species.
Bonjour et bienvenu sur le forum.
Et oui : dire bonjour et se montrer poli ne fait de mal à personne ! 
Ce forum est francophone et n'est pas un distributeur automatique de corrigés !
Si tu veux de l'aide : commence par expliquer ce que tu as compris et ce qui t'empêche de finir l'exercice en posant des questions précises. L'aide apportée ensuite sera plus efficace qu'un simple corrigé pas nécessairement adapté à ton niveau.
Bonjour
Je suis désolé .En fait j'avais commencé l'exercice mais je suis bloqué sur la démonstration de la question numero 3. Je n'arrive pas à trouver l'équation final de solubilité de gibbsite.
Cordialement.
La solubilité « s » est la quantité de solide dissout par litre à l'équilibre (solution saturée). Imagine que s mol/L de solide soit dissout. Les s mol/L d'éléments Al sont présents soit sous forme de Al3+, soit sous forme d'hydroxyde d'aluminium aqueux soit sous forme d'ions aluminate. Cela donne :
Chacune de ces quatre concentrations peut s'exprimer en fonction des constantes d'équilibre fournies et en fonction de . Tu vas alors obtenir la solubilité sous la forme :
Voici une courbe susceptible de t'aider et de t'auto-corriger. J'ai représenté les variations en fonction du pH du logarithme décimal de la solubilité.
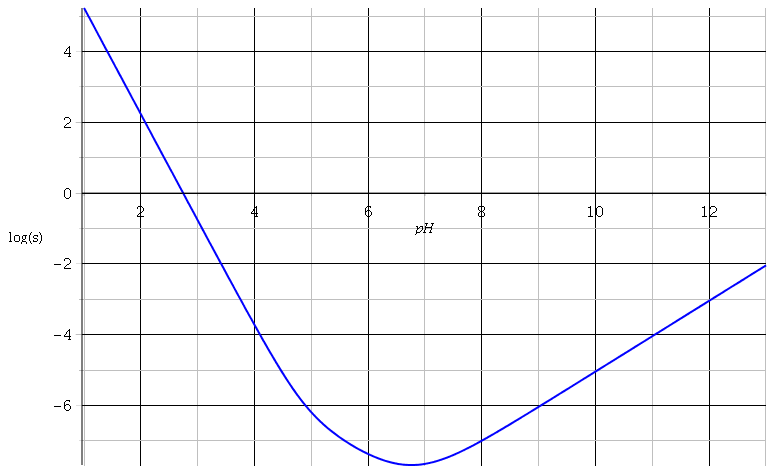
Bonjour,
oui c'est ça mais je n'arrive pas trouvé exactement le résultat de solubilité afin e placer le graphique en fonction du pH.
ma réponse de S = [ Ksp] + [H+] + 1/( AL3+ + ALOH2+ +AL(OH)2+ +AL(OH)3+ + AL(OH)4-)
Je voudrais savoir est ce que ma réponse est juste concernant la solubilité de gibbsite.
cordialement


