Inscription / Connexion Nouveau Sujet
exercice réaction acido-basique
Bonjour à tous !
Alors voilà, ayant un exercice de réaction acido-basique à faire pour la rentrée je me suis retrouvé bloqué au milieu de l'exercice. Un peu d'aide serait la bienvenue !
Enoncé : L'acide sulfurique est fort pour sa première acidité. La seconde activité à un pKa de 2. Donner le diagramme de prédominance en fonction du pH pour les espèces dérivant de l'acide sulfurique en solution aqueuse. Déterminer les concentrations à l'équilibre des ions H3O+, HO-, HSO4- et SO4(2-), ainsi que le pH d'une solution d'acide sulfurique de concentration 6,0.10^-3 mol.L-1
Concernant la première partie de la question j'ai réalisé le diagramme de prédominance avec H2SO4 à gauche, puis après -3,0 j'y ai mis HSO4- et enfin après 2 j'ai noté SO4(2-). Malheureusement pour les concentrations à l'équilibre je ne vois pas comment commencer la rédaction ni par quel moyens nous allons obtenir le résultat à la question posée...
Merci d'avance pour votre aide !! 
Bonjour
En solution aqueuse, un pKa négatif signifie juste que l'acide est fort. Tu peux scanner ton diagramme ?
Pour la suite, connaissant le pH et le pKa du couple HSO4-/SO42-, la formule bien connue :
permet d'obtenir le rapport des deux concentrations : .
Tu peux aussi écrire la relation entre les concentrations des différents ions traduisant l'électroneutralité de la solution...
Rien de bien méchant, je cherchais juste à avoir deux approches différentes du problème pour voir comment y parvenir de façons différentes 
Voici le diagramme demandé ! J'ai juste rajouté les deux réactions d'acidité au dessus pour bien me les rappeler.
Que pensez vous de mon diagramme ?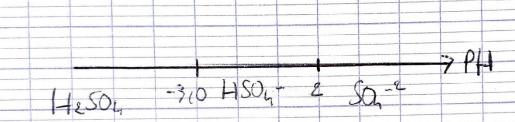
***Image recadrée : le texte doit être recopié***
Non ! H2SO4 étant un acide fort, il se dissocie totalement dans l'eau : les molécules H2SO4 n'existent pas dans l'eau. Il faut juste tracer la frontière à pH=2 comme tu l'as fait.
Je t'ai indiqué à 18h42 une méthode permettant de répondre aux différentes questions en deux lignes...
Débrouille-toi !


 ) :
) :

