Inscription / Connexion Nouveau Sujet
Exercice oxydoréduction
On considère une solution A, qui contient Fe3+ et Fe2+ a des concentration initiale égales a 0.1M
Ecrire les réactions de précipitation de Fe(oH)3 et Fe(oH) 2.
Donner les expression des produits de solubilité, ks(Fe(oH) 3) et ks (Fe(oH) 2). Calculer le ph de début de précipitation de Fe(oH) 3 et Fe(oH) 2
On realise la pile suivante :
Fe3+(0.1M) /Fe2+(0.1M) // Zn2+(0.1M) / Zn
1- Calculer le potentiel des electrodes et préciser les demi-reaction d'oxydoreduction qui y on lieu
2-Donner la réaction globale de fonctionnement de la pile et la pileet 3-calculer sa constante d'équilibre K
4-Calculer le potentiel au point d'équivalence
Données : E°(Fe3+/Fe2+) = +0.77V ;E°(Zn2+/Zn) =-0.76V ; Ks (Fe(oH) 3). =10*(-37) ; ks (Fe (oH) 2)=10*(-15)
S'il vous plait j'ai besoin d'aide
Je bloque dans la question de pH et la dernière question ( question 4)
Bonsoir
pH de début de précipitation : tu te places dans le cas limite où l'équilibre de précipitation existe :
[Fe3+][HO-]3=Ks3
avec une quantité de précipité formé totalement négligeable : [Fe3+]=c
Tu en déduis la concentration limite en ions hydroxyde puis le pH limite. Même méthode pour les ions fer(II).
Ah oui j'ai suivui cette méthode j'ai voulu juste confirmer
et pour la question 4 le potentiel au point d'équivalence je bloque carrément !!
Le point d'équivalence c'est l'équilibre !! Normalement a l'équilibre la pile est morte( ne début plus ) donc le potentiel est égale a 0 .
Meci
Bonsoir
La question 4 est très mal posée. Parler ici d'équivalence n'a pas de sens ; Il s'agit sûrement d'étudier l'équilibre. Comme tu l'as écris, la pile ne débite plus de courant : la différence de potentiels (pas le potentiel) entre les deux demies piles est nulle. Il s'agit à mon avis de déterminer le potentiel commun aux deux demies piles, soit la valeur commune aux deux potentiels de Nernst à l'équilibre.
Bonsoir
dans la question
3-a) fe³+/fe²+ // zn²+/zn => c'est la représentation formelle d'une pile :le pôle négatif est placé a gauche donc le couple (fe³+/fe²+) va subir une réaction d'oxydation et l'inverse mais le potentiel standard de ce dernier est supérieur a E° du (zn²+/zn) !!!! donc c le contraire il va subir une réduction
esk j'ai raté un truc ?!!si je me suis trompée svp dites moi
Bonjour
tu as raison : l'habitude est de représenter à gauche, l'électrode négative, ce que ne fait pas ton énoncé ; de plus : le pont salin est représenté par un double trait, un changement de phase par un simple trait, les espèces d'une même phase étant séparées par une virgule. Cela donne ici :
J'ai fait une petite recherche sur Google mais j'ai trouvé qu'il n'est pas possible d'utiliser le zinc pour réduire les ions fe³+
Car les ions fe²+ formés sont réduits en fer !! Je n'ai pas compris pourriez vous m'expliquer !
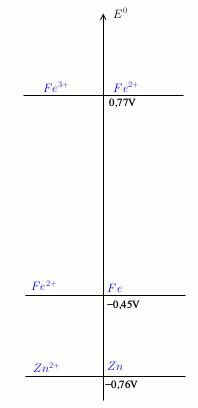
Je te fournis le diagramme des potentiels standard en tenant compte du couple Fe2+/Fe. Tu connais sûrement la règle du "gamma"...
Il est exact qu'en présence de zinc, les ions fer(II) peuvent être réduits en fer de façon quasi totale :
Zn + Fe2+ = Zn2+ + Fe
Cependant, cette réaction ne se produit pas en présence d'ions fer (III). Imagine qu'une partie des ions Fe2+ formés par la réduction des ions fer(III) soit réduits en fer par la réaction précédente. Ce fer serait immédiatement oxydé en ions fer(II) selon la réaction quasi totale :
2Fe3+ + Fe = 3Fe2+
Tu peux donc traiter le problème ici en tenant compte uniquement de la réaction :
2Fe3+ + Zn = 2Fe2+ + Zn2+