Inscription / Connexion Nouveau Sujet
Étude d'un gaz réel
Bonjour,
Je suis en sup prépa bcpst et je rencontre des difficultés sur la dernière question d'un exo portant sur le modèle des gaz parfaits.
1) tracer la courbe si le gaz est parfait
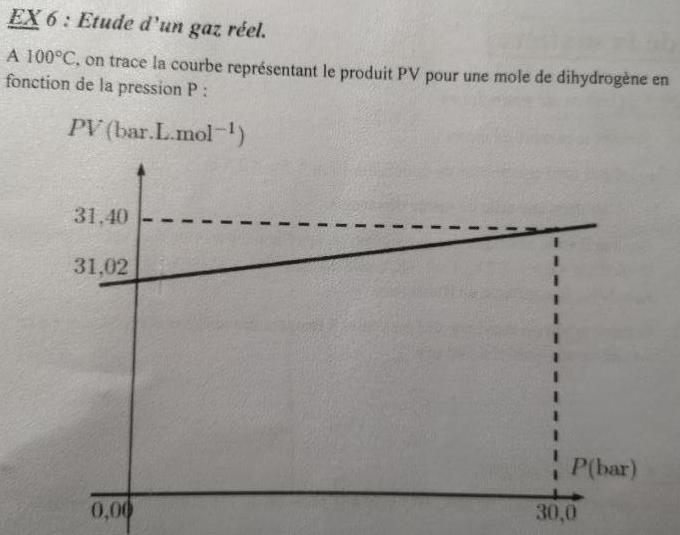
- j'ai tracé une droite parallèle à l'axe des abscisses car la température étant fixée à 100°C, le produit PV est constant.
2) On prend 300L de H2 sous 1 bar qu'on comprimé jusqu'à atteindre un volume de 10L de manière isotherme. Calculer la pression obtenue si H2 est considéré comme parfait
- PV = constante car la compression est isotherme (= la température est fixée). J'ai appelé situation a la situation initiale et b la situation finale.
PV = cste donc on peut écrire :
PaVa = PbVb  Pb= (PaVa) / Vb
Pb= (PaVa) / Vb
AN Pb = 30 bars
3) on considère maintenant H2 comme un gaz réel.
à) déterminer à l'aide du graphe le volume molaire à 100°C sous une pression de 1 bar.
- Vm = (PV) / P = 31,02 L.mol^-1
b) en déduire la quantité de matière considérée dans l expérience.
- Vm = V/n  n= V/Vm
n= V/Vm
AN n= 300/31,02 = 9,7 mol
c) Calculer la pression réelle obtenue.
- je pense qu'il faut adapter la courbe à la situation car elle est tracée pour une mole de H2 et notre expérience porte sur 9,7 moles de H2 mais je ne sais pas comment faire.
Pouvez vous vérifier mes premières questions ainsi que me guider pour la question 3)c)? Merci
Bonjour
Le produit P.V est le produit d'une grandeur extensive (V) par une grandeur intensive (P) : le produit PV est donc proportionnel à n la quantité (en moles) de gaz, que celui-ci soit considéré comme parfait ou non.
La courbe te fournit la courbe PVm=f(P) où Vm désigne le volume molaire. Tu obtiens le produit PV pour n moles par :
P.V = n.P.Vm
Je comprend bien ce que tu m expliques mais je ne vois pas en quoi ça m'avance pour déterminer la pression après compression...
Je connais n qui est constant.
Je connais le V final.
Je peux donc calculer le Vm final...
Mais comment trouver P?
Après compression, le volume est de 10L, le volume molaire est donc égal à :
Vm=(10/9,7)L/mol
La courbe obtenue étant une droite, tu peux écrire :
PVm=A.P +B où A et B sont deux constantes faciles à déterminer.
Puisque Vm est connu, tu obtiens une équation à une seule inconnue P...
Contrairement à ce que fait ton énoncé, tu as tout intérêt, au niveau des notations, à bien faire la différence entre V, le volume de n moles et Vm le volume molaire...
La méthode que tu utilises est la bonne. Tu as tout de même un peu arrondi en prenant 31,02 comme ordonnée à l'origine des abscisses alors qu'il s'agit de la valeur pour P=1bar. Sans faire cette approximation, on obtient comme équation de la droite :
P.Vm=0,0131.P+31,0069 (unités de l'énoncé).
On obtient alors comme pression finale 30,37bar que l'on doit arrondir à 30,4bar. Ton erreur n'est pas très importante...



