Inscription / Connexion Nouveau Sujet
équilibres de phases
Bonjour,
Je suis étudiant en licence chimie de synthèse. J'ai un exercice de génie chimique sur les équilibres de phases à faire pour nous exercer. Mais, je rencontre des difficultés et je ne comprends pas tout. Si quelqu'un pourrait m'éclaircir, je l'en remercie d'avance ! 
Voici l'énoncé :
L'objectif est de séparer un mélange de A et de B par une distillation continue. Le tout se fait à pression atmosphérique. La charge de la colonne contient 50% en masse de A. La quantité à distiller est de 15 tonnes. Le débit à distiller est de 1500 kg/h. Le condenseur est régulé. Ainsi, il y a une condensation totale des vapeurs. La colonne est dimensionner de façon à ce que le titre massique du pied soit de 2% et en tête de 95%.
ATTENTION : tous les calculs seront faits en mole.
Voici les données fournies :
M(B) : 153.82 kg/ kmol
M(A) : 84.93 kg/ kmol
cp du soutirat = cp B =cp A : 0.6 kcal/kg°C
Kinox : 500 kcal/m2 °C
alpha :2.8
T°eb B : 76.9°C
T°eb A : 40°C
Voici le tableau des titres massiques du mélange binaire :
| Xa | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 |
| Ya | 0,220 | 0,460 | 0,620 | 0,715 | 0,785 | 0,8425 | 0,880 | 0,920 | 0,9675 |
| T (en °C) | 69,6 | 61,4 | 55,8 | 52,8 | 50.8 | 49,1 | 47.85 | 46,6 | 44,6 |
Questions :
a) Tracer le fuseau y f(x) en titre molaire
En ordonnée on aura T (°C) et en abscisse les titres molaires du mélange binaire (donc xa et ya. Le tableau au-dessus nous donne les titres massiques. Ainsi, je suppose qu'à partir de ces données, il faut faire des calculs pour pouvoir trouver les titres molaires.
Prenons l'exemple pour Xa = 0,1 --> titre massique
On veut xa --> titre molaire
Or xa = nA
Du coup il faut chercher nA ?
Or on sait que Xa (titre massique) =
Ainsi, à paritr de Xa, on trouve nA. Donc pour Xa = 0,1 :
Donc nA = 0,28
Mais je pense que mon raisonnement est faux car pour Xa = 0,4 ; 0,5 ; 0,6 ; 0,7 ; 0,8 ; 0,9, j'obtiens des valeurs de xa (titres molaires) supérieures à 1. Or elles doivent être inférieure...
b) Le mélange binaire présente-t-il un azéotrope ?
Là, il faut regarder le courbe obtenu à partir de la question a). On en déduit ainsi la réponse.
c) Déterminer les débits molaires de l'alimentation, du distillat et du soutirat
Je sais qu'un débit molaire s'exprime en mol/h.
Du coup, pour le débit molaire de l'alimentation, il faut multiplier le débit d'alimentation (1500kg/h) par quelque chose afin d'obtenir des mol/h. Mais je n'arrive pas à trouver....
Pour le débit molaire du distillat et du soutirat, je n'ai aucune idée...
d) Donner les T° de pied , tête et alimentation
T° pied et en tête : Je pense que l'on détermine ça à partir du graphique tracé dans la question a) ?
Je ne sais pas ce que l'on entend par T° de l'alimentation ?
Bonus :
e) Pour un facteur de charge de 1, avec f = u * racine ( masse volumique) avec u en m/s et masse volumique ( kg/m3) déterminer :
- u vitesse des gaz en tête de colonne
- masse volumique des gaz en tête de colonne
- diamètre de la colonne.
f) Même question mais pour une pression de fonctionnement de 25 mbar
Pour ces deux questions, je bloque complètement. Je n'ai aucune piste et je n'ai jamais traité cela en cours. Si vous pouvez me donner quelques pistes afin que je puisse avancer...
J'ai vraiment envie de comprendre cette exercice et je vous remercie par avance pour votre aide

Bonne soirée à vous !
Bonjour
Je vais d'abord te dépanner concernant la relation entre fraction molaire xA et fraction massique XA.
Je divise tous les termes par et je remarque :
Cela conduit à :
Je te laisse simplifier et continuer...
Concernant le passage des débits massiques aux débits molaires :
tu connais la fraction molaire xA du mélange. Tu peux donc considérer qu'une mole de mélange est constituée de xA mole de A et de (1-xA) mole de B. Tu peux donc définir la masse molaire moyenne du mélange :
La quantité en moles de mélange correspondant à une masse m de mélange est donc :
Je te laisse continuer...
Merci beaucoup pour votre aide. Je comprends mieux les choses désormais.
a) Pour la relation entre fraction molaire xA et fraction massique XA :
Vous avez tout divisé par (mA + mB). Pourquoi ? C'est pour pouvoir y introduire XA dans la formule (étant donné que nous ne connaissons pas mA et mB) ?
J'ai appliqué la formule (sans l'avoir simplifiée) mes résultats sont en pièce jointe.
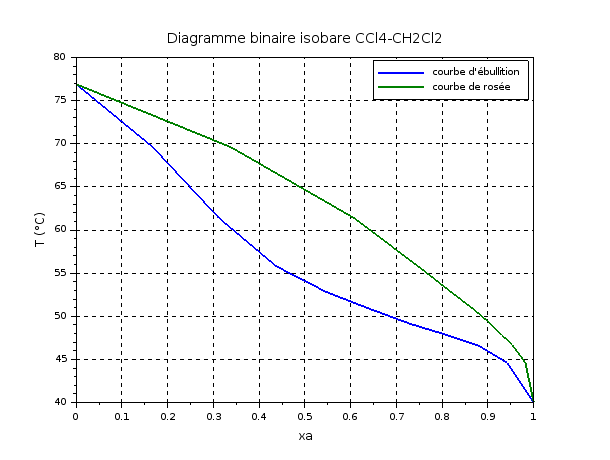
b) J'ai également tracé le diagramme binaire. Il est également en pièce jointe. On peut voir qu'il n'y a pas d'azéotrope. On a un seul faisceau.
c) Pour la conversion des débits massiques en débits molaires, j'ai compris la démarche mais :
Nous avons plusieurs fractions molaires calculées dans la partie a). Je n'arrive pas à trouver celle qui correspond au mélange... On nous dis que : ''La charge de la colonne contient 50% en masse de A. Donc xA = 0,5 ?
Si on connait xA, on peut ainsi calculer n car on connait aussi MA, MB et m ( = 10 tonnes). Mais il faut faire attention aux unités et mettre m en kg non ? C'est bien cela ?
Ensuite, on a n. Du coup on sait que le débit massique est de : 1500 kg/h et qu'on a 10t, on en déduit h (le temps). Et on divise n par h (pour avoir le débit molaire ?). Je ne suis pas certain...
Vous avez tout divisé par (mA + mB). Pourquoi ? C'est pour pouvoir y introduire XA dans la formule (étant donné que nous ne connaissons pas mA et mB) ?
C'est effectivement pour faire apparaître les expressions de XA et XB=1-XA
J'ai également tracé le diagramme binaire. Il est également en pièce jointe. On peut voir qu'il n'y a pas d'azéotrope. On a un seul faisceau.
OK pour l'absence d'azéotrope. Pour le diagramme : il faut le compléter avec les points d'abscisses xa=0 et xa=1 qui correspondent respectivement à B pur et A pur. J'ai fait le tracé histoire de vérifier tes valeurs. Tes calculs sont corrects mais il y a trop peu de mesures pour obtenir quelque chose de précis.
Pour la suite : je pense que le vocabulaire utilisé, très spécifique au génie chimique, t'a été défini en cours...
Rebonjour
D'accord je vois ! Merci !
J'ai consulté l'exercice corrigé. Ainsi, j'ai d'abord calculé la fraction molaire de la charge : 0,64, du distillat : 0,97 et du soutirat : 0,036. J'ai ensuite calculé la masse molaire moyenne du mélange : 109,73 kg/mol. J'en ai déduis n : 136,7 kmol (15000/109.73). Or le débit est de 1500kg pour 1h donc pour 15000 kg (15t), on trouve 15h. Pour 15000kg (ou 136,7 kmol) on a 15h. Donc le débit molaire d'alimentation est de 9,11 kmol/h (=136.7/15).
Ensuite j'ai déterminé le débit molaire de distillat et de soutirat :
J'ai réalisé un système. On a 2 équations à 2 inconnus (comme dans l'exercice corrigé).
J'ai ainsi trouvé : débite molaire de distillat : 5,89 kmol/h et de soutirat : 3,219 kmol/h.
Je ne suis pas certain de ce que j'ai fais. Mais, cela à l'air d'aller dans le bon sens...
d) Donner les T° de pied , tête et alimentation :
L'énoncé nous dit : "La colonne est dimensionner de façon à ce que le titre massique du pied soit de 2% et en tête de 95%."
Du coup, je suppose qu'il faut reprendre les fractions molaires trouvées ci-dessus : charge (alimentation) : 0,64, du distillat : 0,97 et du soutirat : 0,036. Ensuite, il faut se placer sur le diagramme et on en déduit ainsi la température. Qu'en pensez-vous ?
Je pense que tu as maintenant compris l'essentiel. J'ai repris ton calcul concernant le débit molaire de la charge.
xa=0,644 ; masse molaire moyenne : M=109,44kg/kmol
Je trouve que tu te compliques la vie pour le débit molaire. Une masse m=1500kg de mélange correspond à une quantité :
Le débit molaire est donc égal à 13,7kmol/h
Je te laisse rectifier la suite.
Remarque : en toute rigueur, il faudrait arrondir les résultats numériques en fournissant autant de chiffres significatifs qu'il y en a dans la donnée la moins précise de l'énoncé. Problème : de nombreux énoncés ne sont pas très cohérents sur ce plan. Je conseille dans ces cas de fournir trois chiffres significatifs mais attention : il faut conserver en mémoire de la calculatrice tous les chiffres significatifs. Sinon, les arrondis successifs peuvent entraîner des erreurs non négligeables.


