Inscription / Connexion Nouveau Sujet
Equilibrer équation réaction d'un complexe
Bonjour je dois équilibrer la réaction de formation de ce complexe:
α[Co(H2O)6]2+(aq) + β Cl-(aq) + γ NH4+ (aq) + δ NH3(aq) + H2O2(aq) ->
α[Co(NH3)5Cl]Cl2 (s) + ε H2O(l) par la méthode du nombre d'oxydation en précisant l'oxydant et le réducteur mais je ne vois pas comment faire.
Je sais que dans cette réaction on utilise le peroxyde d'hydrogène pour oxyder les ions cobalt. Du coup le peroxyde va se réduire en eau.
La demi équation est je pense: H2O2+ 2H+ +2e-=2H2O
Mais pour le suite je suis un peu perdu..
Pouvez vous m'indiquer comment avancer?
Le point de départ est correct : H2O2 "consomme" 2 e-
Comme le texte l'indique, il faut donc calculer le nombre d'oxydation du Cobalt côté produit et réactif pour trouver  .
.
Que trouvez-vous comme no ?
Pour [Co(H2O)6]2+ il me semble que c'est +2
Pour [Co(NH3)5Cl]Cl2 je ne vois pas du tout c'est un peu compliqué non?
OK pour +II
Pour l'autre avec la règle somme des no = charge, ce n'est pas très compliqué, d'autant plus que l'on reconnait immédiatement NH3 neutre.
Ok j'imagine que le Cl est plus électronégatif que le cobalt cependant le Cobalt ne peut pas être à +5?
Je pense qu'il y a une erreur de recopie du sujet : on ne peut avoir du "même côté " NH3 et NH4+.
Soit on est en milieu basique, on utilise NH3 et on équilibre les charges par des HO-.
Soit on est en milieu acide, on utilise NH4+ et on équilibre les charges par des H+.
C'est un TP. Voici le mode opératoire de la synthèse du complexe:
Dans un bécher de 150 cm3 introduire 13 cm d'ammoniac concentré et 13 g de chlorure d'ammonium solide puis mettre le mélange réactionnel sous agitation.
Ajouter 4 g de chlorure de cobalt (II) hexahydraté préalablement dissous dans 5 cm d'eau.
A l'aide d'une pipette, verser lentement dans le mélange, 3 cm3
d'eau oxygénée à 30 %. Une addition trop rapide risque de provoquer la décomposition du produit, sans oxyder les ions cobalt (II).
Placer le bécher sur une plaque chauffante munie d'un agitateur. Chauffer vers 60°C une dizaine de minutes.
Si on obtient une pâte, ne pas la laisser sécher.
Ajouter alors 50 cm3 d'acide chlorhydrique à 3 mol.L-1 et chauffer le mélange pendant 5 minutes, sans dépasser 60°C.
Filtrer le précipité sur disque fritté. Le laver à l'eau glacée puis à l'acétone (petites quantités et arrêt de l'aspiration lors des lavages).
Achever le séchage du produit dans l'étuve à 110°C pendant 5 minutes puis peser le complexe obtenu.
Donc OK au vu du protocole.
Dans ce cas équilibrer d'abord NH3 (le groupe ...) donc 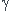 +
+ = ?
= ?
Puis équilibrer en charge pour trouver 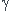 et
et 


