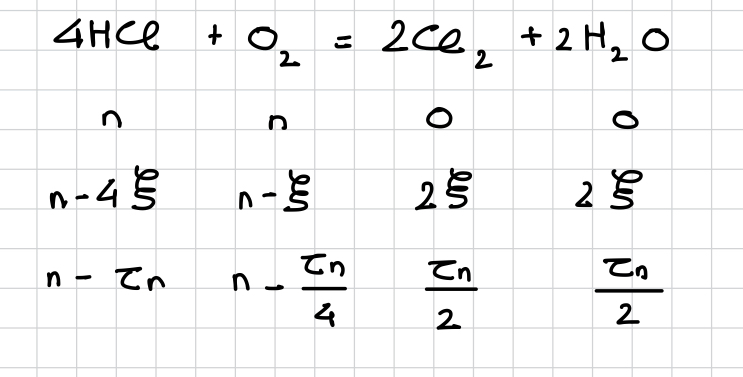Inscription / Connexion Nouveau Sujet
Équilibre dynamique - Détermination de constante d'équilibre
Bonsoir,
Je sollicite votre aide car je bloque sur un exo d'équilibre chimique.
J'ai la réaction suivante :
4HCl + O2 -> 2Cl2 + 2H2O.
Le taux d'avancement est 0.8 et on introduit HCl ainsi que O2 de manière équimolaire. La pression est constante à 1 bar.
J'ai commencé par faire mon tableau d'avancement en  (ci-joint), que j'ai obtenu car O2 est le réactif limitant.
(ci-joint), que j'ai obtenu car O2 est le réactif limitant.
À l'équilibre,
K = (p(Cl2)^2*p(H2O)^2)*p0 / (p(HCL)^4*p(O2))
Je remplace les pressions partielles par le produit de la pression totale avec les fractions molaires et j'obtiens
K = ( n/2)^2)*(
n/2)^2)*( n/2)^2)*p0 / (n-n
n/2)^2)*p0 / (n-n )^4)(n-
)^4)(n- n/4)*ptot
n/4)*ptot
Le problème est que si je factorise, j'obtiens une formule dépendante de n.
Pouvez-vous m'aider et me dire si il y a une faute s'il-vous-plaît ?
Merci d'avance.