Inscription / Connexion Nouveau Sujet
Equilibre de dissociation
Bonjour
J'ai un DM à rendre pour la rentrée, et je bloque sur l'un des exercices. Pourriez-vous m'aider svp?
3- Equilibre de dissociation:
A 300 K, la constante d'équilibre N2O4(g)=2NO2(g) est K=0,166. L'état d'équilibre peut être caractérisé par la valeur du coefficient de dissociation.  =
=
1- Quelle est la valeur de  à 300 K:
à 300 K:
a) sous la pression totale de 1 bar?
b) sous la pression totale de 0,2 bar?
2- Sous quelle pression  serait-il égal à 0,99?
serait-il égal à 0,99?
Monter que la mesure de la densité (par rapport à l'air) du mélange gazeux en équilibre pourrait permettre ce connaitre la valeur de  .
.
Avec un tableau d'avancement, si je pose n(N2O4(g))0 = n0, je trouve à l'équilibre n(N2O4(g))=n0-n(N2O4(g))dissocié et n(2NO2)=2n(N2O4(g))dissocié
Or  =
= , on a donc n(N2O4(g))dissocié=
 n0.
n0.
PV=ntRT, où P la pression totale et nt la quantité de matière totale.
 nt =
nt =
or nt= 2*n0* + n0(1-
+ n0(1- )
)
nt= n0( +1)
+1)
On a donc  =
= -1
Je bloque à partir d'ici car il me manque des données pour l'application numérique, je ne sais pas si j'ai appliqué la bonne méthode avec les données mises à ma disposition (car je n'ai pas encore touché à la constante d'équilibre K).
Voila, merci d'avance.
Bonjour
Ton début de raisonnement sur le tableau d'avancement est correct mais ensuite, il faut utiliser le fait qu'à l'équilibre, le quotient de réaction est égal à la constante d'équilibre. Il est assez facile d'exprimer le quotient de réaction Qr en fonction de  , P (pression totale) et P° (pression standard de 1bar).
, P (pression totale) et P° (pression standard de 1bar).
La suite est seulement "calculatoire". Je te laisse réfléchir à tout cela. Poste à nouveau si tu bloques quelque part...
Bonjour
J'ai essayé de calculer Qr de la sorte:
Qr= 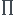
, avec Pi =
*Pt.
J'ai cependant un doute au niveau de la quantité de matière de NO2.
En effet, j'avais écrit n(2NO2)=2* *n0.
*n0.
Dans ce cas dans l'expression de Qr, dois-je prendre n(NO2)= *n0, puis élever au carré?
*n0, puis élever au carré?


