Inscription / Connexion Nouveau Sujet
Equilibre de complexation + Réaction de précipitation
Je coince sur deux exercices si quelqu'un peut me venir en aide.
Voici l'énoncé:
Exercice 1: Equilibres de complexation
L'ion diphosphate est un ligant pour l'ion cuivrique
, avec lequel il forme deux complexes d'indices de coordination 1 et 2. Leurs constantes successives de formation sont telles que :
.
1. Ecrire les équations-bilan des formations successives des 2 complexes et en déduire l'expression littérale des constantes de formation associées. Etablir la relation algébrique qui relie ces constantes à , respectivement.
2. On définit . Pour construire le domaine de prédominance des espèces du cuivre en milieu diphosphate, démontrer pour quelle valeur de
a-t-on
et pour quelle valeur de
a-t-on
$
Définir les conditions de prédominance des complexes du cuivre. Etablir leur diagramme de prédominance.
3. Etablir la composition à l'équilibre des 3 solutions suivantes. Leurs conditions de concentrations initiales sont données dans le tableau suivant.
Mélange 1
Mélange 2
Mélange 3
Exercice 2: Réactions de précipitation
Le chlorure d'argent AgCl est un solide dont le produit de solubilité dans l'eau est
.
1.Ecrire l'équation-bilan de la dissolution de AgCl dans l'eau pure. A partir de l'expression littérale de la constante d'équilibre etablir l'expression de la constante en fonction des concentrations l'équillibre des espèces en solution.
2. On dispose d'une solution A de de concentration égale à
. Ecrire l'équation bilan de la dissolution de
. Sachant que ce sel se dissout quantitativement dans l'eau, construire le tableau d'avancement de la réaction , en exprimant l'abondance des espèces par les valeurs de leur concentrations.
3. Construire le tableau d'avancement de la réaction de dissolution de AgCl dans la solution A, en fonction de , la concentration d'ions
provenant de A, et en fonction de s2, la solubilité de AgCl dans A.
4. Il existe une autre approche pour calculer s2. Pour cela, on utilise l'expression établie en 1, qui définit s en fonction de pCL. Ecrire cette expression e n y faisant apparaitre s2, pour calculer s2. Emettre une hypothèse qui permettre de calculer s2. Calculer s2. Vérifier si l'hypothèse est valide.
Voici mes éléments de réponses:
POur l'exercice 1
1 Les équations bilans sont:
1:
2:
Expression littérale des constantes de formation associées:
A partir de la question 2, je coince
Pour le 3, je ne comprends pas ce qu'il veulent dire par composition à l'équilibre?
POur l'exercice 2, je ne comprends car on me parle de dissolution alors que c'est une précipitation. Et d'après le cours, la précipitation est la réaction inverse?
Merci pour votre aide.
Bonjour
Concernant l'exercice sur les complexes successifs, tu peux commencer par lire attentivement le document suivant, essentiellement les parties II et III :
![]()
Cela devrait déjà beaucoup t'aider. Si cela ne suffit pas, n'hésite pas à poser sur ce forum d'autres questions.
Pour la questions 3) : on te donne les quantités introduites par litre ; il s'agit de déterminer les concentrations quand les équilibres de complexations sont obtenus, ce qui se produit au bout d'un temps très court : les cinétiques de ces réactions sont très rapides...
Complément à propos des précipités.
Si tu mets du chlorure d'argent solide dans l'eau, il va se dissoudre très partiellement car il s'agit d'un solide très peu soluble dans l'eau. La constante de cette réaction de dissolution, notée Ks est très petite devant 1.
Inversement, si, à une solution contenant des ions chlorure, tu ajoutes une solution contenant des ions argent, les ions argent et les ions chlorure réagissent de façon quasi totale pour donner du chlorure d'argent solide ; il y a précipitation quasi totale : la constante de la réaction de précipitation est l'inverse de la précédente, elle est très grande devant 1.
Bonjour à tous,
POur la question 1 de l'exercice 1, pour vérifier si j'ai bien compris, quand ils parlent d'expression littérale des constantes de formation associées.
S'agit-il des et des
? Puisqu'il s'agit de constantes successives de formation?
Par la suite, on en déduit les constantes de dissociation associées qui sont les réactions inverses:
et
Puis on poursuit le raisonnement pour déterminer :
POur la question 2, pour la démonstration faut-il commencer à chercher la frontière en écrivant que ?
OK pour les relations entre constantes ; suivant les auteurs, la constante de formation est notée Kf ou 
Pour la suite, tu as une forte analogie entre complexe et acide : un acide est un donneur d'ions H+ ; un complexe est un donneur de Ligand que je vais noter L pour simplifier à la place de .
Le complexe que je vais noter ML2 pour simplifier, est l'analogue d'un diacide : il peux perdre successivement ses deux ligands :
première étape :
Constante d'équilibre :
Passage aux logarithmes décimaux en multipliant tous les termes par (-1) :
On obtient ainsi :
seconde étape :
Je te laisse démontrer, par une méthode analogue :
ce qui te permettra de terminer le diagramme de prédominance, sur le modèle des diagrammes de prédominance en théorie acide/base .
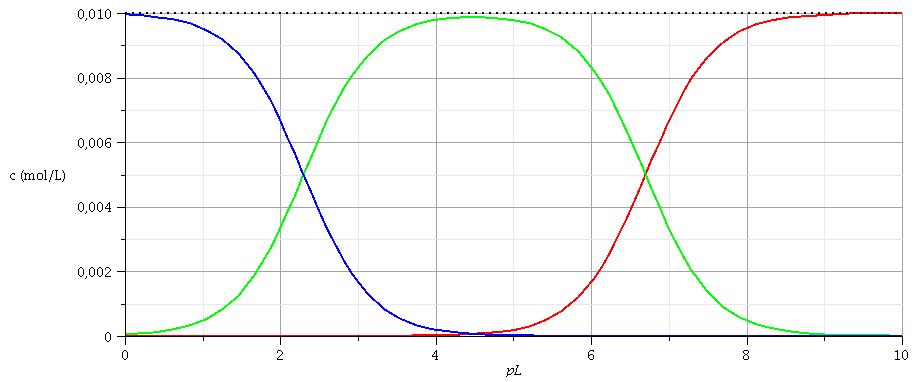
Pour t'aider, voici une simulation donnant les concentrations en ,
et
en fonction de
pour une quantité d'ions Cu2+ introduite par litre égale à 10-2mol/L. Tu pourras identifier les trois courbes et remarquer les cas particuliers pL=pKd1 et pL=pKd2...