Inscription / Connexion Nouveau Sujet
Épreuve de partiel exo 1.0
Bonjour, j'aurais besoin de votre aide pour résoudre un exercice en chimie organique. Je bloque dès la 2) question ^^". Merci d'avance de votre aide.
L'énoncé :
Soit un composé (À) possédant comme seule fonction oxygénée une fonction alcool. La combustion de 6,8 g de (À) dans suffisamment d'air produit 19,8 g de CO2 et 5,4 de H2O.
1. Calculer les quantités de matières de CO2 et H2O produites par la combustion.
N m/M
N(CO2) - 19,8/12,0 +16,0x2 - 4,50x10-1 mol-1
N(H2O) - 5,4/1,0+16,0 - 3,00x10-1 mol-1
2. En déduire les masses de carbone et d'hydrogène produites par la combustion de (À)
3. Calculer les pourcentages massique en carbone, hydrogène et oxygène du composé (À)
Je pensais utiliser %Cm=(M(Ç) x a)/M(À)
%Hm =(M(H)x b)/M(À)
%Om=(M(O) x c)/M(À)
Après comme on qu'un seul groupe fonctionnel qui est l'alcool sa voudrait dire que O=1
4. Donner, pour le composé (À) les expressions littérales des pourcentages massiques en carbone et oxygénée en fonction de la masse molaire de À.
5. En déduire la formule brute de À.
Je vois comment faire, je vais utiliser la formule de 3) et trouver à,b,c de
6. Sachant que (À) possède un groupement phénol et deux groupements méthyle équivalents, proposer une structure pour l'alcool (À)
Premièrement je vais calculer le nombre d'instaurations i=(2x+2+t-m)/2
Bonjour,
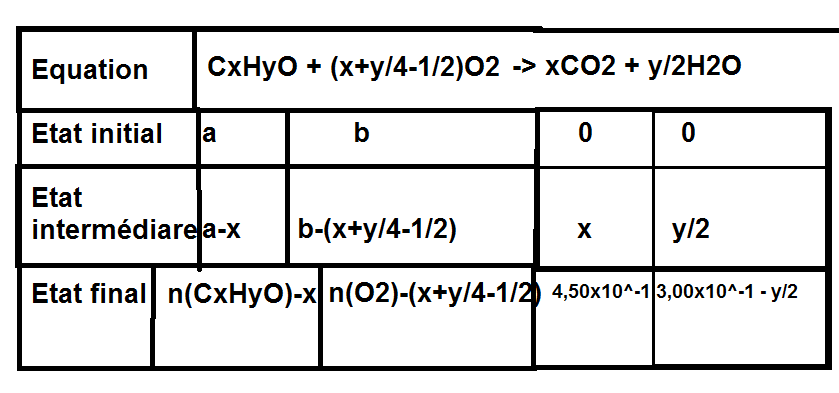
Une suggestion : écrire l'équation de la réaction de combustion ainsi :
où x et y sont deux nombres entiers positifs.
Remplis un tableau d'avancement ; tu y verras sans doute plus clair ensuite...
OK ; ensuite : calcule la masse de carbone contenue dans 0,45mol de CO2 puis écris que ce carbone était intégralement contenu dans les 6,8g de A. Raisonnement analogue pour H à partir de l'eau... Tu pourras enchaîner la suite...
Je suis pas très sûr encore ^^"
Alors j'ai fais :
0,45=
X=24,3 g de C dans CO2
m(c) dans À = 24,3/6,8=3,57
Bonjour
Dans une mole de CO2 il y a 12g de carbone ; dans 0,45mole de CO2, tu as donc :
12 x
0,45 = 5,4g de carbone. Ce carbone était initialement présent dans les 6,8g de A.
Le pourcentage massique de carbone dans A est donc de 79,4%
Dans une mole d'eau, il y a 2g d'hydrogène ; la masse d'hydrogène contenue dans les 0,3mol d'eau est donc : 0,6g
Cet hydrogène est initialement présent dans les 6,8g de A. Le pourcentage massique d'hydrogène dans A est donc de 8,8%
Par différence, le pourcentage massique d'oxygène vaut : 11,8%
Je te laisse continuer...
9Me voilà alors
Sachant qu'il y a un seul groupe alcool soit un seul atome d'oxygène, je me sers de la formule :
%Om=()x100
M(A) =
M(A) =
M(A) = 135,59
Après j'ai repris toutes mes formules du début pour trouver la formule : C9H12O
OK. Il s'agit d'une molécule de phénol C6H6O dans laquelle les atomes H en positions 2 4 et 6 sont remplacés par 3 radicaux alkyles. Tu a dû voir en cours qu'un radical OH oriente les substitutions en positions ortho et para