Inscription / Connexion Nouveau Sujet
Enthalpie libre
Bonjour,
En essayant de tracer un diagramme d'Ellingham, je me suis aperçu de quelque chose que je ne saisissais pas. On s'intéresse à l'équilibre :
On la relation :
On a aussi :
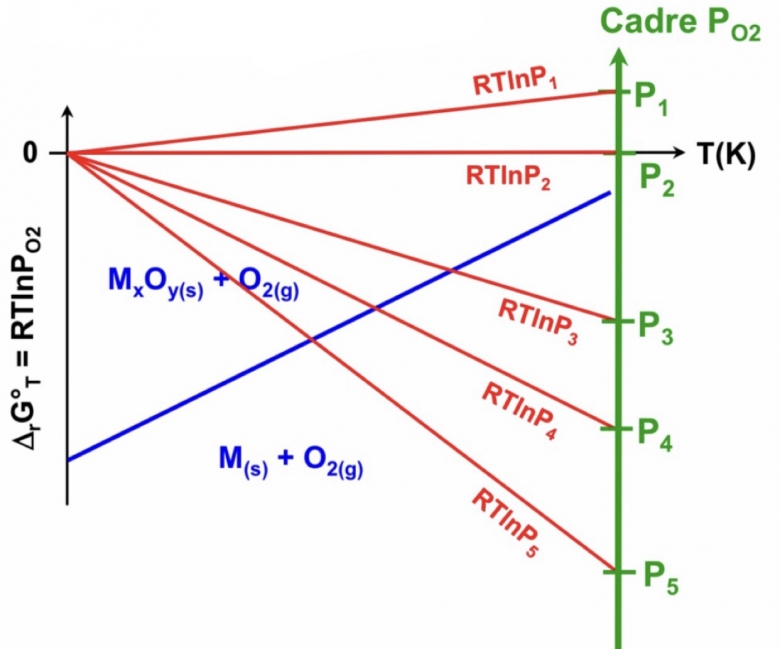
A l'intersection des deux droites, pour un température donnée, on peut déterminer la pression de
à l'équilibre.
Puisque ces deux relations sont les mêmes (), pourquoi est-ce qu'elles ne sont égales que pour une valeur de T ? Ces droites devraient être confondues. Et si on nous demande la valeur de
pour une température T donnée, on prend quelle valeur ? C'est quelque chose de très basique mais je bloque. Ça doit être une histoire d'équilibre... merci d'avance.
Bonsoir
La notion d'affinité chimique est-elle a ton programme?
Attention : la deuxième expression de l'enthalpie libre standard de réaction que tu fournis est fausse dans le cas général. Elle n'est valide que dans le cas particulier de l'équilibre chimique où le quotient de réaction est égal à la constante d'équilibre de la réaction.
Je comprends que tu ne comprends pas. L'axe de gauche représente les variations en fonction de T de l'enthalpie libre standard de réaction (courbe bleue ) et aussi (il faut enlever le signe egal) les variations de RTlog(PO2) en fonction de T pour différentes pressions partielles en O2(courbes rouges ).
A l'intersection des 2 droites la température est la température d'équilibre . Je te laisse étudier les cas où la courbe rouge est au-dessus ou au-dessous de la courbe bleue.
Et "l'enthalpie libre standard de réaction en fonction de T" ce n'est pas la même chose que "la variation de RTlog(P(O2)) en fonction de T" ?
Pas du tout. Par exemple, pour PO2=0,2bar, tu obtiens en rouge la droite passant par l'origine de coefficient directeur R.ln(0,2).
L'enthalpie libre standard de réaction correspond à la droite tracée en bleu dont tu as fourni l'équation.
Il te faut absolument étudier un cours sérieux sur les diagrammes d'Ellingham pour bien comprendre.