Inscription / Connexion Nouveau Sujet
Dosages pH-métriques
1 - On dose une solution d'hydrogénocarbonate de sodium NaHCO3 (pK = 6,4 et 10,3 ; prises d'essai : 20 mL) par une solution d'acide chlorhydrique HCl 0,1 N et par une solution d'hydroxyde de sodium NaOH 0,1 N également pour le deuxième dosage. Les deux dosages donnent un point d'équivalence identique à 11,9 mL.
1) Expliquer brièvement pourquoi les deux dosages donnent le même volume équivalent.
2) Calculer la concentration en g.L-1 de la solution en hydrogénocarbonate de sodium NaHCO3.
3) Tracer les deux courbes de dosage pour les volumes de solutions titrantes versées de 0 à 25 mL, en calculant les pH de 0,5 mL en 0,5 mL, en écrivant les formules de calcul dans chaque intervalle de volume
(v = 0 ; 0 < v < véquivalence ; véquivalence ; v > véquivalence).
Je suis totalement perdu et en particulier pour la 3 ème question .... Comment fait on pour calculer le pH au dessus du volume équivalent ? Quelqu'un pourrait il m'aider ?
L'ion hydrogénocarbonate est une espère amphotère qui peut soit réagir sur un acide, soit réagir sur une base.
Pour la question 1, tu peux partir du diagramme des pKa pour trouver la réaction de titrage et montrer qu'il s'agit d'une réaction quasi totale (constante d'équilibre très grande devant 1.
Pour l'ensemble du problème, tu peux t'inspirer du document suivant (étapes I et IV) :
![]()
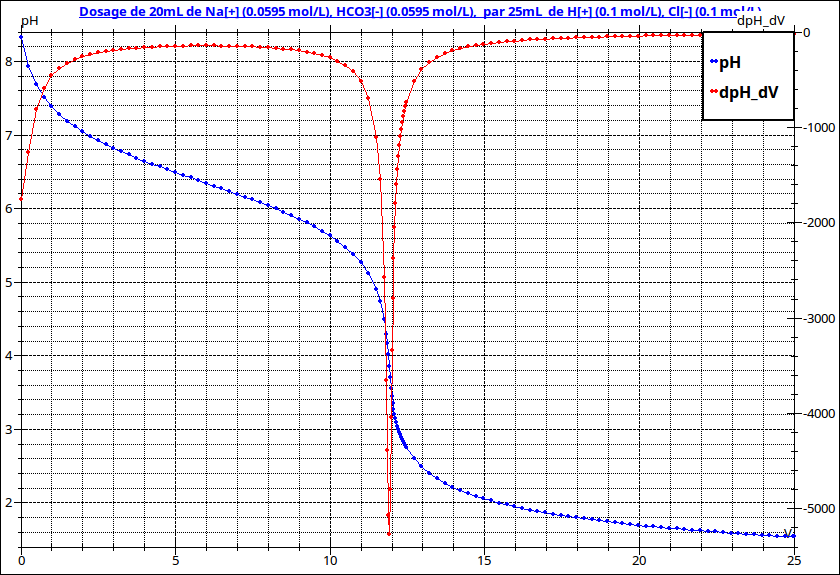
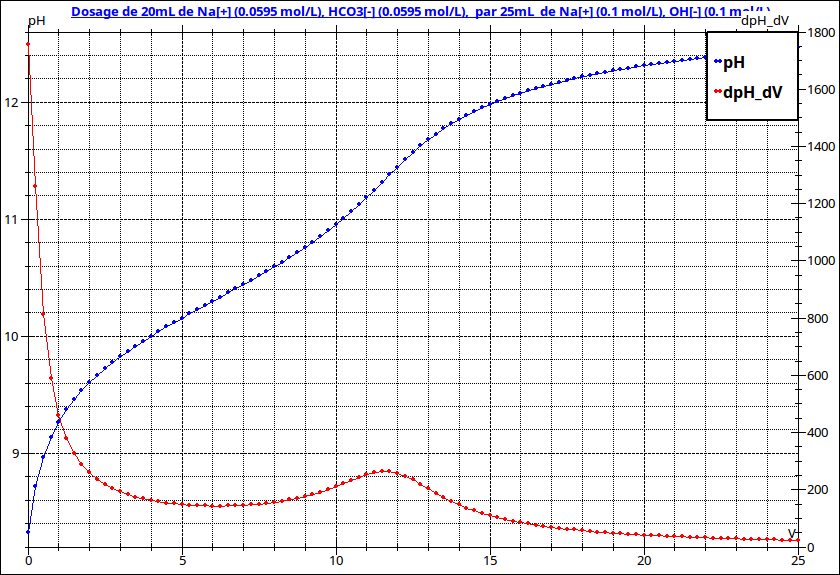
Je te fournis les courbes de titrages de ta question 3 qui te permettront de t'autocorriger.
Remarque : Comme le montre le tracé (en rouge) des courbes dérivées, le second dosage correspond à un saut de pH très peu prononcé, ce qui rends peu précis la détermination expérimentale du point d'équivalence... Le dosage par l'acide chlorhydrique est en pratique beaucoup plus précis.
Bonjour, vanoise
Pour la question 3) je suis également perdu et je n'arrive pas à déterminer les formule du pH à utiliser dans chaque cas et pour les 2 dosage.
Merci d'avance 😊😊
Dans chacun des deux cas, il faut remplir des tableaux d'avancement sur le modèle de ceux fournis sur le document que je t'ai fourni : un tableau pour chacun des quatre cas :
v = 0 ; 0 < v < véquivalence ; véquivalence ; v > véquivalence
Quelques indications tout de même.
Pour v=0, tu as une solution d'hydrogénocarbonate de sodium de concentration 0,0595mol/L. C'est une espèce amphotère. Le tableau des pKa montre que la réaction prédominante est :
ce qui conduit à :
Écris les expressions des deux pKa à l'équilibre ; tu verras facilement que l'égalité précédente conduit à :
Dosage par l'acide chlorhydrique : à l'équivalence, la solution est une solution d'acide carbonique de concentration :
En imaginant l'acide très peu dissocié, tu obtiens le pH par la relation :
Dosage par la soude : à l'équivalence, la solution est une solution de carbonate de sodium de concentration cb égale à ca puisque les volumes équivalents sont identiques. En supposant les ions carbonate réagissant très peu dans l'eau, tu obtiens le pH par la relation :
Pour les volumes avant et après l'équivalence, les tableaux d'avancement conduisent simplement aux résultats. Je te laisse réfléchir à tout cela...
Bonsoir vanoise, étant très nul en chimie je n'arrive pas à savoir si NaHCO3 est mono/di ou triacide.
Si vous pouviez m'éclairer svp
Et j'ai toujours du mal à distinguer donc les formules de pH pour chacun des quatre cas
Si j'ai bien compris je fais à tableau d'avancement avec les concentrations et en fonction des ka de chacun des cas j'obtiendrai le pH ??
Merci 😊
Par exemple pour le dosage de NaHCO3 par NaOH:
A v=0 —> pH=1/2 (pka - log c)
Pour 0<v<veq —> pH=pka + log [(cb vb)/ (ça va - cb vb )]
Pou v=veq —> pH= 1/2 ( pka + pke + log ( ça va / va + vb ) )
Et pour v>veq —> pH = 14 + log [( cb vb - ça va )/(va +vb)]
Merci de me dire si je suis sur la bonne voie
NaHCO3 est un solide qui en se dissolvant de façon totale dans l'eau, libère des ions sodium et des ions hydrogénocarbonate. Les ions sodium sont spectateurs. La bonne question est donc : "les ions dihydrogénocarbonate ont-ils des propriétés acide ou basique ? " La réponse est : "les deux " car ces ions sont amphotères ; ils se comportent en base en présence d'un acide et en acide en présence d'une base. C'est pour cela que le dosage peut se faire soit par l'acide chlorhydrique soit pas la soude.
Dosage par l'acide chlorhydrique selon la réaction quasi totale :
Dosage par la soude selon la réaction quasi totale :
Je me rends compte que, dans ces conditions, tu n'as sans doute pas compris grand chose à mes précédents messages. Il n'est pas possible sur un forum de refaire un cours complet couvrant le programme de terminale S et le programme de première année de licence. Il te faut absolument trouver un cours précis et cohérent sur ce sujet.
Je crois bien que nos derniers messages se sont croisés. Mon message de 16h03 traite le cas v=0 et les cas des 2 équivalences. J'ai bien peur que ce message ne soit pas compris...
Ah oui effectivement j'ai essayé de le refaire de mon côté donc j'ai oublié de revoir ce que vous aviez envoyé pour vérifier, autant pour moi ! Merci 
Re bonjour vanoise, pour le dosage avec NaOH je trouve les même valeurs que vous mis à part quelques unes à partir de 9,5 ml et ce jusqu'au volume équivalent je me demande si il y a un lien avec pKa-1...
Bonjour
L'intérêt de cet exercice est d'illustrer le caractère amphotère de l'ion hydrogénocarbonate. En revanche, comme déjà signalé, le dosage par la source est délicat sur le plan expérimental (saut de pH pas très “net”) comme sur le plan théorique car la réaction de titrage :
a pour constante d'équilibre :
Cette constante est nettement supérieure à 1 mais pas assez élevée pour que l'on puisse considérer la réaction comme quasi totale pour 0,8Ve<v<Ve environ. Souvent, on ne fait pas le calcul dans cette zone. On détermine le pH à l'équivalence par la méthode indiquée dans un précédent message et on termine le tracé de la courbe à “main levée”. Si tu y tiens, je te fournis le calcul dans le cas particulier v=10mL.
Il faut d'abord écrire l'équation d'électroneutralité de la solution :
Les ions hydrogénocarbonate réagissent partiellement pour former soit des ions carbonate soit de l'acide carbonique :
Les ions sodium sont spectateurs et proviennent à la fois de l'hydrogénocarbonate de sodium et de la soude :
Je pose pour alléger les notations. Le pH étant surement nettement inférieur à
il est possible de négliger la présence de l'acide carbonique. On tient compte des constantes d'équilibre :
Donc :
Toujours en négligeant la présence des ions carbonate, l'équation d'électroneutralité devient :
Il ne reste plus qu'à résoudre numériquement ; tu vois : tout est simple ! 
On obtient :
Bonjour, je suis en licence et j'ai le même exercice, autant pour la première question ça va, la troisième question après avoir lu le sujet, c'est ce à quoi je pensais. Mais alors la deuxième question quand je dois trouver la concentration en g.L-1, je ne vois pas du tout comme y arriver, peut être que j'oublie quelque chose.
Bonjour Adrizir
Si je comprends bien ton message, tu es en train d'expliquer que réaliser le dosage pHmétrique d'une espèce amphotère ne te pose aucun problème mais que tu as des difficultés à passer de la concentration molaire c en mol/L à la concentration massique cm en g/L. La masse molaire M de NaHCO3 est connue...
Bonjour Vanoise
Je sais comment on passe d'une concentration molaire, a massique mais je ne vois pas comment trouver ma concentration molaire...
Selon l'énoncé :
Les deux dosages donnent un point d'équivalence identique à 11,9 mL
La concentration de la solution titrante est connue : 0,1mol/L ainsi que le volume de la solution d'hydrogénocarbonate de sodium à doser : 20mL.
En plus : le résultat est indiqué en titre des courbes de titrage que j'ai fournies.
Merci j'avais pensé à ça mais je me suis dis que je ne pouvais pas prendre la concentration de HCL et NaOH
L'ion hydrogénocarbonate étant une espèce amphotère, il peut réagir de deux façons différentes.
1° : sur l'acide chlorhydrique : réaction quasi totale :
2° : sur la soude : réaction quasi totale :
Dans les deux cas, les quantités d'ions hydrogénocarbonate et les quantités d'ions oxonium ou hydroxyde introduites sont égales à l'équivalence.

 c'est beaucoup plus clair !!
c'est beaucoup plus clair !!
